
 研發(fā)追蹤
研發(fā)追蹤
 生物谷
生物谷  2022-06-20
2022-06-20
 5867
5867
Lagevrio是一種口服給藥的強效核糖核苷類似物,可抑制多種RNA病毒的復制优麻,包括新型冠狀病毒(SARS-CoV-2),這是導致COVID-19的病原體鳍擎。
2022年06月14日訊 /生物谷BIOON/ 近日,默沙東(Merck & Co)與Ridgeback Biotherapeutics公布了來自3期MOVe-OUT臨床試驗(NCT04575597)的額外數(shù)據(jù)衬械。該試驗評估了口服抗病毒藥物Lagevrio(molnupiravir)治療有高風險發(fā)展為嚴重疾病的輕度至中度COVID-19非住院成人患者祷罩。分析顯示,與安慰劑組相比辙霎,Lagevrio組發(fā)生急性護理就診的比例較低隔抒,進行呼吸干預的患者人數(shù)較少(包括有創(chuàng)機械通氣)。相關(guān)數(shù)據(jù)已發(fā)表于《內(nèi)科學年鑒》(The Annals of Internal Medicine)淋憋。詳見:Effect of Molnupiravir on Biomarkers, Respiratory Interventions, and Medical Services in COVID-19FREE课娃。
對預先指定的探索性終點的分析表明,在改良意向治療(MITT)人群中桃序,與安慰劑組相比杖虾,Lagevrio治療組發(fā)生急性護理就診或與COVID-19相關(guān)急性護理就診的患者比例較低:(1)Lagevrio組有7.2%的患者報告在29天內(nèi)有急性護理就診,安慰劑組為10.6%媒熊,相對風險降低[RRR]為32.1%(CI:4.4%-51.7%)奇适;(2)Lagevrio組有6.6%報告了與COVID-19相關(guān)的急性護理就診,安慰劑組為10.0%芦鳍,RRR為33.8%(CI:5.6%-53.6%)嚷往。MITT人群包括隨機分配的所有受試者,他們至少接受了一劑研究藥物柠衅,并且在第一劑研究藥物之前沒有住院皮仁。
根據(jù)事后分析,在MITT人群中茄茁,與安慰劑組相比魂贬,Lagevrio組需要進行呼吸干預的患者人數(shù)較少(包括常規(guī)氧療、高流量加熱加濕設備裙顽、無創(chuàng)機械通氣或有創(chuàng)機械通氣),所有呼吸干預的RRR為34.3%(95%CI:4.3%-54.9%)宣谈。根據(jù)額外的事后分析颅网,在安全性人群中,與安慰劑組相比蜈率,Lagevrio組平均C反應蛋白(CRP)值下降得更早翎憨、更大,相對基線血氧飽和度(SpO2)值的平均變化有更早魔辉、更大的改善磨再。安全性人群包括所有進行隨機分組的受試者借倘,以及至少接受過一劑Lagevrio的受試者。
事后分析還表明莉遥,在隨機化后住院的患者亞組中枣象,Lagevrio組患者出院的中位時間為9天(CI:7至12天),安慰劑組為12天(CI:9至14天)灶逃。與MITT人群數(shù)據(jù)一致舶舅,事后分析還表明,在隨機化后住院的患者中鬼胸,與安慰劑組相比奸闽,Lagevrio組患者需要呼吸干預的人數(shù)較少,所有呼吸干預的RRR為21.3%(95%CI:0.2%-38.0%)恢筝。
molnupiravir由默沙東與Ridgeback Biotherapeutics聯(lián)合開發(fā)哀卫,該藥是一種口服給藥的強效核糖核苷類似物,可抑制多種RNA病毒的復制撬槽,包括新型冠狀病毒(SARS-CoV-2)聊训,這是導致COVID-19的病原體。2021年11月恢氯,molnupiravir獲得英國藥品和保健品管理局(MHRA)批準带斑,成為第一個被批準用于治療COVID-19的口服抗病毒藥物,該藥適用于:SARS-CoV-2診斷檢測為陽性且至少有一種發(fā)生嚴重疾病的風險因素的輕中度COVID-19成人患者勋拟。在美國勋磕,F(xiàn)DA已授予molnupiravir緊急使用授權(quán)(EUA):用于治療直接SARS-CoV-2診斷檢測為陽性、有高風險進展為嚴重疾哺颐摇(包括住院或死亡)的輕度到中度COVID-19成人患者挂滓,以及FDA授權(quán)或批準的COVID-19替代治療方案無法獲得或臨床上不合適的輕度至中度COVID-19成人患者。
除3期MOVe-OUT試驗外啸胧,MOVe-AHEAD試驗正在評估m(xù)olnupiravir用于暴露后預防赶站,這是一項全球、多中心鲫础、隨機惕秧、雙盲、安慰劑對照3期研究嫉卵,正在評估m(xù)olnupiravir在家庭內(nèi)預防COVID-19疾病傳播方面的療效和安全性的炫。
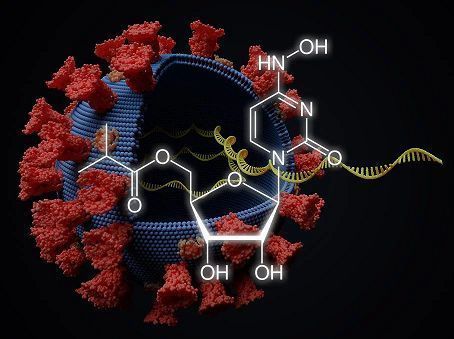
molnupiravir化學結(jié)構(gòu)式(圖片來源:scinexx.de)
molnupiravir是一種口服給藥的強效核糖核苷類似物,可抑制多種RNA病毒的復制移卢,包括新型冠狀病毒(SARS-CoV-2)蜕裳,這是導致COVID-19的病原體。molnupiravir已被證明在SARS-CoV-2的幾個臨床前模型中具有活性,包括用于預防呈锣、治療和預防傳播锤衡,在SARS-CoV-1和MERS的臨床前模型中也顯示出活性。
MOVe-OUT(NCT04575597)是一項全球性2/3期秒准、隨機试郎、安慰劑對照、雙盲憾汛、多地點研究党饮,入組對象是實驗室檢測確認為輕度至中度COVID-19的非住院成人患者(年齡≥18歲),這些患者未接種SARS-CoV-2疫苗驳庭、至少有一個與不良疾病結(jié)局相關(guān)的風險因素刑顺、并且在隨機化前5天內(nèi)出現(xiàn)癥狀。該試驗的3期部分在全球范圍內(nèi)開展饲常,患者以1:1的比例隨機分為2組蹲堂,每天2次口服molnupiravir(800mg)或安慰劑,為期5天贝淤。主要療效目標是通過從隨機分組至第29天期間住院和/或死亡的患者百分比來評估m(xù)olnupiravir(800mg柒竞,每日口服2次,持續(xù)5天)與安慰劑的療效播聪。該試驗中朽基,最常見的疾病預后不良風險因素包括肥胖、高齡(>60歲)离陶、糖尿病和心臟病稼虎。
在MITT人群中所有隨機化患者(n=1433)的分析中,molnupiravir降低了住院或死亡風險:安慰劑組有9.7%(68/699)的患者在隨機分組后至第29天內(nèi)住院或死亡招刨,而molnupiravir治療組為6.8%(48/709)敬挂,絕對風險降低了3.0%(95%CI:0.1,5.9)匣酸。安慰劑組有9例死亡永韭,molnupiravir組有1例死亡。
主要療效的確定基于對762例患者的計劃中期分析卡撤。在中期分析中徊押,與安慰劑相比,molnupiravir將住院或死亡相對風險降低約50%琅瘦。molnupiravir組有7.3%(28/385)的患者在隨機分組后至第29天內(nèi)住院或死亡掖阶,安慰劑組為14.1%(53/377),絕對分析降低為6.8%(95%CI:2.4-11.3乌诚;p=0.0024)。至第29天,molnupiravir治療組沒有報告死亡蜒午,而安慰劑組有8例死亡虎叔。
molnupiravir的安全性基于對MOVe-OUT試驗中隨機化分組且接受molnupiravir(n=710)和安慰劑(n=701)治療5天的1411例COVID-19非住院患者的安全分析評估。molnupiravir治療組最常見的(發(fā)生率≥1%)不良事件為腹瀉(molnupiravir組2%截胯,安慰劑組2%)铺坞、惡心(molnupiravir組1%,安慰劑組1%)洲胖、頭暈(molnupiravir組1%济榨,安慰劑組1%)。因不良事件而中斷研究干預的患者較少(molnupiravir組1%绿映,安慰劑組3%)擒滑。嚴重不良事件發(fā)生率,molnupiravir組為7%叉弦,安慰劑組為10%丐一。最嚴重的不良事件與COVID-19相關(guān)。

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 285
285

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 261
261

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 59
59