
 研發(fā)追蹤
研發(fā)追蹤
 2017-01-03
2017-01-03
 5361
5361
來源:醫(yī)藥魔方??? 2017-1-3
2016年FDA共批準22個原創(chuàng)新藥,包括15個新分子實體和7個新生物制品括堤,其中15個以優(yōu)先審評(P)的方式獲得批準路媚。從企業(yè)角度看泳炉,羅氏绩寂、默沙東彭薪、禮來、Biogen均有2個新藥獲批映僚。
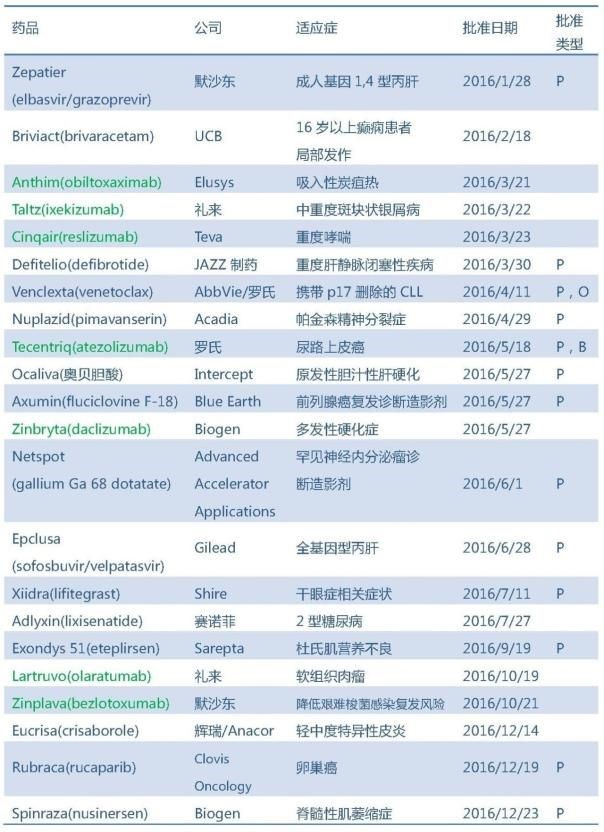
?
注:綠色代表新生物制品
1寞竭、Zepatier,默沙東
FDA 1月28日以優(yōu)先審評方式批準Zepatier(elbasvir 50mg/grazoprevir 100mg)用于治療基因1酣难,4型丙肝谍夭。基因1型是患者數(shù)量最多的丙肝類型憨募,美國近400萬丙肝患者中75%是基因1型紧索。
Zepatier是最早獲得突破性藥物資格的丙肝藥物之一,不過隨著Solvadi(2013/12/6)和Viekira Park(2014/12/19)的快速上市菜谣,FDA認為默沙東和BMS的丙肝藥物相比現(xiàn)有療法不再具有突破性意義齐板,遂于2015年2月取消了它們的突破性藥物資格。但是因為基因4型丙肝葛菇、合并終末期腎病正在進行血液透析治療的基因1型丙肝的醫(yī)療需求仍遠未得到滿足甘磨,FDA又于2015年4月在這個兩個適應(yīng)癥上授予了Zepatier突破性藥物資格。多項臨床研究結(jié)果顯示眯停,Zepatier實現(xiàn)了更高的持續(xù)病毒學(xué)應(yīng)答率济舆,將基因1型丙肝的SVC12從94%提高到97%,將基因4型丙肝的SVC12從97%提高到100%莺债。
Zepatier批準的療程有12周和16周兩種滋觉,具體治療周期取決于HCV基因分型和治療史,對于基因1型丙肝患者讼石,還跟基線時的NS5A基因多態(tài)性有關(guān)苇赊,不多對于大多數(shù)選擇Zepatier的丙肝患者,一般都只需要12周回乞。
2忠辛、Briviact,UCB制藥
美國FDA 2月18日批準Briviact (brivaracetam) 作為其他藥物的附加藥物治療16歲以上癲癇患者的局部發(fā)作夹恨。Briviact 的有效性在3項涉及1550例患者的臨床研究中得到證實哎闻。Briviact聯(lián)合其他藥物能夠有效地降低癲癇的發(fā)作頻率。 Briviact最常見的副作用包括嗜睡闰芒、 頭暈枚林、 疲勞、 惡心墓运、 嘔吐郭菜。
癲癇是一種常見疾病,其特征在于疾病反復(fù)發(fā)作鞍歌,伴有不受控制移動勘伺、肌肉痙攣和行為異常在內(nèi)的典型癥狀。全球約有5000萬癲癇患者,每年新增200萬癲癇患者娇昙。美國大約有500萬癲癇患者尺迂。中國目前約有1000萬癲癇患者,其中600多萬為有發(fā)作的患者冒掌,每年新增癲癇患者40萬噪裕。在癲癇患者中,兒童和青少年仍是癲癇高發(fā)人群股毫。
3膳音、Anthim,Elusys Therapeutics
FDA 3月21日批準Elusys Therapeutics公司的Anthim (obiltoxaximab) 注射液與特定抗生素聯(lián)用铃诬,用于治療吸入性炭疽感染祭陷,以及在不適合替代療法時預(yù)防吸入性炭疽熱。FDA 曾在去年11月23日批準Emergent BioDefense Operations公司的一款疫苗產(chǎn)品BioThrax與特定抗生素療法聯(lián)用趣席,用于疑似或確診炭疽暴露后的炭疽熱預(yù)防兵志。BioThrax也是第一款僅憑借動物實驗數(shù)據(jù)就獲得FDA批準的疫苗產(chǎn)品。
4宣肚、Taltz萝轰,禮來
FDA 3月22日批準Taltz (ixekizumab)注射液80mg/ml,用于治療適合全身療法和光療的中重度銀屑病成人患者好阎。ixekizumab禁用于既往對ixekizumab或任何輔料成分發(fā)生過超敏反應(yīng)的患者疹咕。Taltz已于今年2月獲得歐盟CHMP的推薦批準,是繼諾華Cosentyx之后全球第2個獲批上市的anti-IL17A單抗环胸。
銀屑病是一種慢性铲恃、自身免疫性皮膚疾病,全球患病人數(shù)大約為1.25億进裹。目前雖然有多個藥物獲批治療銀屑病四雏,但由于銀屑病無法治愈,現(xiàn)有藥物只能改善疾病癥狀夭私,因此銀屑病藥物市場是非常有“錢景”的一個領(lǐng)域舷咆。
5、Cinqair添镜,Teva
FDA 3月23日日批準Teva公司哮喘新藥Cinqair(reslizumab),用于以吸入性糖皮質(zhì)激素(ICS)為基礎(chǔ)治療方案但病情控制不佳的血液嗜酸性粒細胞水平升高的18歲以上重度哮喘患者的維持治療唠鹅。
Reslizumab是繼葛蘭素史克mepolizumab(2015/11/4 獲批) 之后FDA批準的第2款anti-IL5單抗藥物窿锉。但FDA未批準reslizumab用于12-17歲青少年哮喘患者。
哮喘是一種呼吸道慢性炎癥膝舅,據(jù)美國疾病控制中心數(shù)據(jù)嗡载,2013年在美國有超過2200萬哮喘患者,每年哮喘相關(guān)住院病例多達40萬。在哮喘患者中洼滚,血液嗜酸性粒細胞水平升高(≥400個細胞/μL)與肺功能受損埂息、持續(xù)的癥狀、急性發(fā)作風(fēng)險的升高相關(guān)遥巴。reslizumab被認為能夠結(jié)合并中和IL-5千康,減少嗜酸性粒細胞炎癥。
6铲掐、Defitelio拾弃,JAZZ制藥
FDA 3月30日批準JAZZ制藥公司Defitelio (去纖維蛋白多核苷酸) ,用于治療成人及兒童患者接受血液或骨髓造血干細胞移植(HSCT)后發(fā)生的肝靜脈閉塞性疾舶诿埂(VOD)合并腎臟或肺功能異常豪椿。這是FDA批準的首個治療重度肝靜脈閉塞性疾病治療藥物。Defitelio是Jazz在2013年10億美元收購意大利藥企Gentium時獲得的藥物携栋。
肝靜脈阻塞是一種罕見卻致命的疾病祸弥,通常見于那些接受過高劑量化療以及血液干細胞移植的血癌患者。肝靜脈阻塞(VOD)的癥狀為肝血管阻塞船庐,進而導(dǎo)致肝內(nèi)血液交換減少和腫脹酬绞,這會造成肝損傷,還有可能累及腎臟和肺功能或祖。接受血液干細胞移植的人群的2%會出現(xiàn)這類并發(fā)癥祖务,而其中80%都是致命的。美國衛(wèi)生資源和服務(wù)管理局在2013年發(fā)布的數(shù)據(jù)表明凰彼,每年美國會實施18000例骨髓或臍帶血移植彭撑。
7、Venclexta葛昏,AbbVie/羅氏
Venclexta 于4月11日獲得FDA加速批準蜈藏,用于單藥治療既往接受過治療的攜帶p17刪除的慢性淋巴細胞白血病(CLL)绝鸡。Venclexta在這個適應(yīng)癥上獲得過FDA授予的突破性藥物資格迂雪,是 FDA批準的首個BCL-2抑制劑。
CLL是最常見的成人白血病舰褪,美國每年約有 15000 新診斷病例皆疹。CLL 的特點是異常淋巴細胞進展性累積, p17刪除約占未經(jīng)治療 CLL 的 10%占拍,占復(fù)發(fā) CLL 的 20%略就。 p17刪除造成抑癌基因的缺失,是最難治療的一類 CLL晃酒。
8表牢、Nuplazid窄绒,Acadia
Nuplazid是FDA批準的首個治療帕金森病性精神病的藥物,是帕金森病性精神病臨床治療的重大里程碑崔兴。
Nuplazid是FDA批準的首個選擇性靶向5-HT2A受體的藥物彰导,這些受體在帕金森病性精神病中發(fā)揮著重要作用。Nuplazid不僅優(yōu)先靶向5-HT2A受體敲茄,同時可避免多數(shù)精神分裂癥藥物所具有的多巴胺受體及其他受體激活副作用位谋。
據(jù)美國國立衛(wèi)生研究院(NIH)數(shù)據(jù),美國每年確診為帕金森癥的患者多達50000例折汞,整個美國大約有100萬例帕金森患者倔幼。全球范圍內(nèi)大約有400-600萬帕金森患者。多達40%的帕金森患者伴有帕金森性精神病整诈,其特征為幻覺和妄想坷磷,為其照料者及家庭帶來了沉重的負擔。
9恒晋、Tecentriq竹坝,羅氏
FDA 5月18日宣布批準羅氏PD-L1單抗Tecentriq (atezolizumab),用于治療鉑類藥物化療后疾病進展或術(shù)前/術(shù)后接受鉑類藥物化療12個月內(nèi)疾病惡化的局部晚期或轉(zhuǎn)移性尿路上皮癌患者止歇。Tecentriq在3月15日獲得了FDA授予的優(yōu)先審評資格磷兢,比預(yù)定的PDUFA審批期限(Tecentriq)提前了近4個月,是FDA批準的首個PD-L1單抗翘辑。
尿路上皮癌占所有膀胱癌的90%狭龄,也可見于腎盂、輸尿管和尿道溜信。2016年美國新確診膀胱癌患者預(yù)計76960例蜘傻,死亡病例為16390例。早期階段確診的膀胱癌患者的5年生存率大約為96%幸双,而晚期階段確診的膀胱癌患者5年生存率僅為39%琅翻。Tecentriq成為首個獲批治療這一最常見類型膀胱癌的PD-1/PD-L1抑制劑。
10柑贞、Ocaliva方椎,Intercept
FDA 5月27日加速批準Ocaliva(奧貝膽酸),聯(lián)合熊去氧膽酸(UDCA)用于UDCA單藥治療響應(yīng)不足的原發(fā)性膽汁性肝硬化成人患者钧嘶,或單藥用于無法耐受UDCA的PBC成人患者棠众。
原發(fā)性膽汁性膽管炎(PBC)是一種肝內(nèi)膽小管漸進性損傷的慢性疾病,主要是因膽管遭到自身免疫性破壞康辑,導(dǎo)致膽汁淤積摄欲。它主要影響女性,目前是美國女性進行肝臟移植手術(shù)的第二大病因疮薇。在歐洲胸墙,該病約占膽汁淤積性疾病所致肝移植病例的一半左右,約占所有肝移植病例的6%按咒。
UDCA是目前唯一獲批治療PBC的藥物迟隅。UDCA可有效治療超過50%的患者。然而励七,多達40%的患者的ALP水平或總膽紅素不會降低智袭,且5%~10%的患者無法耐受UDCA。
FDA曾授予Ocaliva優(yōu)先審查資格剿夫。OCA是一種法尼酯X受體激動劑渊妨,可促進膽汁酸的釋放,開發(fā)用于原發(fā)性膽汁性肝硬化姓拂、非酒精性脂肪性肝炎及其他肝臟疾病和腸道疾病的治療夕涧。此前,FDA已授予OCA治療伴有肝纖維化的NASH的突破性藥物資格寒肋、治療PBC的快車道地位刹讹、治療PBC和PSC的孤兒藥地位。
11易麻、Axumin职予,Blu Earth
Axumin(可注射放射性診斷試劑)5月27日獲得FDA批準,用于前列腺癌復(fù)發(fā)的檢測秽祷。適應(yīng)于治療后PSA升高螺煞,PET檢查可疑前列腺癌復(fù)發(fā)的患者。
Axumin的活性成分為fluciclovineF18矗寂,化學(xué)名為[18F]-1-氨基-3-氟環(huán)丁烷-1-甲酸碳胳,是一種非天然氨基酸,可被位于前列腺癌細胞表面的氨基酸轉(zhuǎn)運體吸收至癌細胞內(nèi)赠摇,前列腺癌細胞比其周圍的健康組織更易于吸收fluciclovine F18固逗,且在吸收后不會將其代謝或用于蛋白質(zhì)合成。
Axumin顯像劑吸收分布較好藕帜,半衰期適當烫罩,與其他兩種診斷試劑相比,可以更精確地確定前列腺癌復(fù)發(fā)病灶的位置洽故。
Axumin 是一種放射性藥物贝攒,應(yīng)采用適當?shù)陌踩胧┨幚恚栽谑褂闷陂g使患者及醫(yī)療保健提供者最小程度地暴露于放射中时甚。Axumin 用于正電子成像術(shù)時會發(fā)生影像判讀錯誤隘弊。
12、Zinbryta荒适,Biogen/羅氏
FDA 5月27日批準了Biogen/AbbVie的Zinbryta(daclizumab)用于治療復(fù)發(fā)緩解型多發(fā)性硬化癥(RRMS)梨熙。Zinbryta是靶向CD25的人源化單克隆抗體藥物开镣,患者可自行給藥且每個月只需注射1次,是目前給藥周期間隔最長的注射用MS藥物锯忱。
需要注意的是常籍,Zinbryta的藥品標簽中附有黑框警告,警示醫(yī)療保健人員該藥可能會引起威脅生命或致命性的嚴重肝損傷以及嚴重的免疫性疾踩蚣恕(如結(jié)腸炎癥锨圣、淋巴結(jié)腫大、過敏反應(yīng))的安全性風(fēng)險过腰,一般情況下骗采,Zinbryta只適用于對2種以上多發(fā)性硬化癥治療藥物響應(yīng)不足的成人患者。
Zinbryta的藥品標簽中還提供了風(fēng)險評估與減輕策略(RESM)的信息橄看,醫(yī)療保健人員應(yīng)監(jiān)測患者的肝功能词趾,患者在每次注射Zinbryta之前都應(yīng)進行血檢,并且在最后1次注射Zinbryta后堅持監(jiān)測6個月暮课。
13法洼、Netspot
NetSpot是一種無菌、靜脈內(nèi)注射使用的單劑量鎵68 DOTATATE試劑盒椎吼,用于正電子發(fā)射斷層掃描成像(PET)眠琴。這種放射性探針可以幫助定位患有罕見的生長抑素受體陽性的神經(jīng)內(nèi)分泌腫瘤(NETs)成人和兒童患者中的腫瘤。
Ga 68 dotatate的吸收水平反映了神經(jīng)內(nèi)分泌腫瘤(NETs)中生長抑素受體的密度姓建。這種吸收也可以在其他各類腫瘤或其他病例條件下觀察到诞仓,Ga 68 dotatate的吸收可能需要通過組織病理學(xué)或其他評估措施確定。
14速兔、Epclusa墅拭,Gilead
FDA 6月28日批準了Gilead公司的Epclusa(索非布韋+ velpatasvir)(SOF+VEL),與利巴韋林聯(lián)用治療伴有或無晚期肝病的基因1~6型丙肝病毒(HCV)感染涣狗。Epclusa是由索非布韋和velpatasvir 組成的固定劑量復(fù)方谍婉,是首個獲批治療全部6種基因型HCV感染的藥物,市場表現(xiàn)極其驚人镀钓。
Epclusa的藥品標簽中帶有警告穗熬,提示胺碘酮與索非布韋聯(lián)用可能會導(dǎo)致嚴重心動過緩并需要起搏治療。因此不推薦Epclusa與胺碘酮同時服用丁溅。
15唤蔗、Xiidra,Shire
干眼癥(dry eye)又名角結(jié)膜干燥癥(KCS)窟赏,是指任何原因造成的淚液分泌不足或淚液動力學(xué)異常妓柜,導(dǎo)致淚膜穩(wěn)定性下降,并伴有眼部不適和(或)眼表組織病變特征的多種疾病的總稱棕健。
干眼癥是目前最為常見的眼表疾病寸纠,發(fā)病率與年齡和性病有關(guān)雳雄,30~40歲成人發(fā)病率為5%,65歲以上老人的發(fā)病率為10%~15%吴烹,女性發(fā)病率高于男性斯凑。美國大約有2900萬干眼癥患者肾俯。
Xiidra( Lifitegrast)屬于first in class的淋巴細胞功能相關(guān)抗原-1(LFA-1)拮抗劑眨攀。LFA-1是存在于白細胞表面的一種蛋白。在干眼癥中乡纸,ICAM-1在角膜和結(jié)膜組織中過量表達扛聂。LFA-1/ICAM-1相互作用促進免疫突觸的形成,導(dǎo)致T細胞激活并遷移至目標組織坪秒。
lifitegrast是Shire在2013年花費了1.6億美元從美國SARcode Bioscience收購而來栏付,被預(yù)測銷售峰值可超過10億美元,獲得過FDA的優(yōu)先審評資格煞嫩。lifitegrast的上市之路并不平坦组弥,Shire在去年10月收到了FDA的CRL,并補做了一項名為OPUS-3的III期臨床研究來回答CRL中的各項問題逗爹。
16亡嫌、Adlyxin,賽諾菲
Adlyxin(lixisenatide)是繼艾塞那肽(阿斯利康)掘而、利拉魯肽(諾和諾德)挟冠、阿必魯肽(GSK)和度拉魯肽(禮來)之后全球第5個上市的GLP-1受體激動劑。不過最近上市的阿必魯肽和度拉魯肽都屬于每周注射1次的長效制劑袍睡。
Lixisenatide最常見的治療相關(guān)不良反應(yīng)主要包括惡心知染、嘔吐、頭痛斑胜、腹瀉和頭暈控淡,以及與磺酰脲和基礎(chǔ)胰島素類似的低血糖癥。另外止潘,臨床研究中也有接受Lixisenatide治療患者發(fā)生全身性過敏的報告掺炭。Lixisenatide禁用于1型糖尿病患者以及酮酸水平增高的患者。
FDA同時要求賽諾菲開展Adlyxin的上市后研究覆山,包括考察Lixisenatide在兒童患者中的劑量竹伸、療效和安全性,以及考察Lixisenatide的免疫原性福互。
17刹由、Exondys 51,Sarepta
杜氏肌營養(yǎng)不良是一種尚無法治愈的侵襲性鹉鉴、退行性遺傳疾病妨菩,每3600名新生男嬰中糙枚,將會有一名男嬰受到此病的影響。DMD妨礙肌肉運動厚饱,極易引發(fā)早期死亡和高風(fēng)險的心臟-呼吸衰竭檐伞,臨床上唯一有效的治療手段是糖皮質(zhì)激素類固醇藥物,類固醇有嚴重的副作用捕如,不能長期服用切拳。在不經(jīng)治療干預(yù)的情況下,患者會在十幾歲的時候完全喪失行走能力揩池,在20~30歲左右丟掉性命孽倒。
Exondys 51(eteplirsen)注射液之前也被FDA咨詢委員會投票否決過,但獲得過孤兒藥資格泪桥、快速通道資格救鲤、優(yōu)先審評資格的eteplirsen最終還是憑借可以使肌營養(yǎng)蛋白含量增加0.28%的替代終點獲得FDA加速批準。
Exondys 51是FDA 批準的首個杜氏肌營養(yǎng)不良(DMD)新藥秩冈,用于確認攜帶肌營養(yǎng)蛋白基因第51號外顯子跳躍突變的DMD患者本缠。據(jù)統(tǒng)計,DMD患者中有13%存在51號外顯子跳躍突變入问。
18丹锹、Lartruvo,禮來
軟組織肉瘤是起源于脂肪队他、筋膜卷仑、肌肉、纖維麸折、淋巴及血管等組織的惡性腫瘤锡凝。據(jù)美國癌癥研究所統(tǒng)計,2016年美國將有12310例新確診病例和5000例死亡病例垢啼。對于無法手術(shù)的軟組織肉瘤患者窜锯,最常見的治療藥物是多柔比星或其他藥物。
olaratumab是一種血小板源性生長因子受體α(PDGF-Rα)單抗芭析,可通過抑制PDGF-R的激活來抑制腫瘤生長悄贴。
FDA授予過Lartruvo孤兒藥資格,以及在上述適應(yīng)癥上的快速通道資格傀掘、突破性藥物資格和優(yōu)先審評資格诈绷。FDA 10月19日加速批準Lartruvo(olaratumab),聯(lián)合多柔比星用于不合適放射治療或手術(shù)但適合蒽環(huán)類藥物的特定類型軟組織肉瘤圃星。禮來還需要開展后續(xù)研究怒央,向FDA提供更多的有效性證據(jù)。
19、Zinplava项请,默沙東
Zinplava(bezlotoxumab)是一種單抗藥物烦盛,其作用不是直接殺菌,而是中和艱難梭菌毒素B肚轴,后者會對小腸壁造成損傷紧邑,從而引發(fā)腹瀉。默沙東2009年以 6000 萬美元預(yù)付款及 1.65 億美元里程金從Medarex獲得了Zinplava的開發(fā)授權(quán)稠还。BMS之后以24億美元收購了Medarex伞缺。
約四分之一的艱難梭菌感染患者在首次發(fā)作后出現(xiàn)復(fù)發(fā),其中超過40%的患者后再次發(fā)生復(fù)發(fā)惜姐,這表明需要繼續(xù)尋找能夠打破感染周期循環(huán)的新方法犁跪。
據(jù)美國CDC的數(shù)據(jù)顯示,僅2011年歹袁,美國近50萬人發(fā)生艱難梭菌在感染,其中29000例在初診后30天內(nèi)死亡寝优。
默沙東表示最早于2017上半年將該藥推向市場条舔,瑞士信貸預(yù)測該藥物有望在2020年之前達到3億美元的銷售額。
20乏矾、Eucrisa孟抗,輝瑞/Anacor
過敏性皮炎是一種常見的復(fù)發(fā)性慢性炎性皮膚疾病,患者通常表現(xiàn)為以炎癥和瘙癢為特點的慢性皮疹钻心,好發(fā)于皮膚褶皺處凄硼,癥狀通常會持續(xù)14天以上,影響1800萬~2500萬美國人捷沸,其中嬰兒和兒童占8%~18%摊沉。過敏性皮炎缺少有效的治療藥物,FDA過去15年未曾批準一個治療過敏性皮炎的新分子實體痒给。
Eucrisa(crisaborole)是一種含硼的小分子抗炎藥用六,屬于非甾體PDE4抑制劑,治療過敏性皮炎的作用機制尚未完全闡明红狗。
輝瑞在2016年5月17日與Anacor達成交易烂锤,以52億美元全現(xiàn)金收購Anacor,將crisaborole收入囊中暂呈。輝瑞計劃將在明年1月推出該產(chǎn)品架暗,出廠價580美元/管(60克)。Eucrisa預(yù)測年銷售峰值可達20億美元辜辰。
21约粒、Rubraca,Clovis Oncology
Rubraca(rucaparib)是全球第2個上市的PARP抑制劑,用于單藥治療既往接受過兩種以上化療的BRCA突變晚期卵巢癌奈兢。
PARP是一個獨特的靶點喻秩,可以抑制DNA修復(fù)。腫瘤細胞在復(fù)制時依然需要保持DNA的相對完整啼插,同樣離不開DNA修復(fù)娃肃。不過正常細胞體內(nèi)存在多條DNA修復(fù)的信號通路,而腫瘤細胞有時會發(fā)生突變破壞其他DNA修復(fù)通路(DNA修復(fù)缺陷型腫瘤細胞)粱锐,因此抑制PARP這個靶點對于某些突變類型腫瘤具有很好的療效疙挺。
在賽諾菲的第一個“烏龍”PARP抑制劑死在III期之后,眾多在該靶點布局的制藥巨頭喪失信心怜浅,默沙東把niraparib賣給了Tesaro铐然,BioMarin把talazoparib賣給Medivation,Clovis的這個Rucaparib原本也是輝瑞的資產(chǎn)恶座。
隨著niraparib一夜爆紅之后搀暑,PARP這個靶點引發(fā)了大家的廣泛關(guān)注,不僅Medivation有了與收購方談判的強力籌碼跨琳,rucaparib也拯救了飄飄欲墜的Clovis自点。
22、Spinraza脉让,Biogen
SMA是一種罕見的致命性遺傳病桂敛,主要影響肌肉力量和運動,患者主要表現(xiàn)為全身肌肉萎縮無力溅潜,身體逐漸喪失各種運動功能术唬,甚至是呼吸和吞咽。發(fā)病年齡墅瑟、癥狀和進展速率具有很大的變異性避扎。
SMA是2歲以下嬰幼兒群體中的頭號遺傳病殺手,在新生兒中的患病率為1:6000-1:10000壁歧,中國大約有患兒3~5萬人催岔。
Spinraza是一種反義寡核苷酸,可改變SMN2基因的剪接段扛,增加全功能性SMN蛋白的生產(chǎn)惑叶,是全球首個獲批治療脊髓性肌萎縮癥的藥物。Spinraza此次是以加速批準方式獲得FDA批準袁虽,審評周期僅3個月旭绝。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 86
86

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 86
86

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 85
85