
 研發(fā)追蹤
研發(fā)追蹤
 藥渡Daily
藥渡Daily  2022-07-11
2022-07-11
 2325
2325
2022年7月5日滚吱,Genentech宣布胶逢,F(xiàn)DA日前受理公司的first-in-class雙特異性抗體Mosunetuzumab的BLA申請,并同時授予該產(chǎn)品優(yōu)先審評資格,適應癥為復發(fā)性/難治性(R/R)濾泡性淋巴瘤(FL)成人患者坷襟,這些患者此前至少接受過2次系統(tǒng)治療构蹬。
來源:Genentech官網(wǎng)
此次BLA是基于Mosunetuzumab的一項名為GO29781的關鍵I/II期臨床研究的積極結果溃蔫。該研究數(shù)據(jù)顯示皆疹,在先前接受過2次或2次以上治療的R/R FL患者中,Mosunetuzumab誘導了持續(xù)至少18個月的持久完全緩解蝶怔,完全緩解率(CR)為57% [95% CI:49-70])奶浦,并且顯示了可控的耐受性。中位無進展生存期(PFS)為17.9個月(95%CI:10.1-不可評估)踢星。在病情緩解的患者中澳叉,中位緩解持續(xù)時間(DOR)為22.8個月(95%CI:9.7-不可評估)。最常見的不良反應事件(AE)是細胞因子釋放綜合征(39%沐悦;n=86/218)成洗,通常為低別級(1級:25.6%;2級:14%所踊;3級:2.3%泌枪;4級:0.5%),停藥后會消退秕岛。其他常見的不良反應事件(AE)(>20%)包括:疲勞碌燕、頭痛、中性粒細胞減少继薛、發(fā)熱和低磷血癥预旺。治療是在沒有強制住院治療的情況下進行的,由此可見灯彩,Mosunetuzumab具有很高的安全性浪熙。該結果已于2021年12月在第63屆美國血液學會(ASH)年會暨博覽會上首次公布。GO29781研究(NCT02500407)是一項I/II期阵蔚、多中心锨蹄、開放標簽、劑量遞增和擴展的臨床研究扶免,旨在評估Mosunetuzumab在復發(fā)或難治性B細胞非霍奇金淋巴瘤患者中的安全性努墩,有效性和藥代動力學特征吠冒。研究終點指標包括獨立評價機構(主要終點)的完全緩解率(最佳反應)、客觀緩解率引晌、反應持續(xù)時間焙恬、無進展生存期、安全性和耐受性(次要終點)赌骏。
關于濾泡性淋巴瘤(FL)
濾泡性淋巴瘤(FL)是一種濾泡生發(fā)中心B細胞轉(zhuǎn)化來的惰性成熟B細胞非霍奇金淋巴瘤(NHL)琢窗,發(fā)病率僅次于彌漫大B細胞淋巴瘤(DLBCL),占美國所有成人NHL的20-40%晒杈,在歐洲和亞洲較少見嫂伞。它通常對治療應答良好,但又特別容易多次復發(fā)桐智∧┰纾患者再次復發(fā)時烟馅,會變得更難治療说庭,早期進展可能與長期預后不良有關。預計2022年美國將有13,000名患者被診斷為FL郑趁。龐大的FL患者群體急需療效更好的藥品刊驴。此次Mosunetuzumab向FDA遞交BLA,無疑是“雪中送炭”寡润。預計FDA將在2022年12月29日之前給出裁決捆憎。
關于Mosunetuzumab
Mosunetuzumab是Genentech研發(fā)的CD20/CD3雙特異性抗體,通過同時結合2種不同細胞上的2個不同靶點(惡性B細胞表面的CD20梭纹,T細胞表面的CD3)來發(fā)揮作用躲惰。這種雙重靶向作用可激活和重新定向患者現(xiàn)有的內(nèi)源性T細胞,結合并通過向目標B細胞內(nèi)釋放毒性蛋白來消除這些惡性B細胞晶襟。這種雙重靶向療法驳达,為包括非霍奇金淋巴瘤(NHL)和多發(fā)性骨髓瘤(MM)在內(nèi)的血液腫瘤提供了一種創(chuàng)新的治療方法。
目前笼肴,Mosunetuzumab仍在開展多項臨床研究缆瑟,包括聯(lián)合來那度胺二線治療FL的CELESTIMO研究以及聯(lián)合維博妥珠單抗二線治療彌漫性大B細胞淋巴瘤 (DLBCL)的SUNMO研究等兩項III期臨床試驗。
Mosunetuzumab研發(fā)進展

來源:藥渡數(shù)據(jù)庫
研發(fā)里程碑
2022年7月5日峦爪,Genentech向FDA提交Mosunetuzumab的BLA申請嫁慌,同時獲FDA授予優(yōu)先審評資格認定。
2022年6月3日辅蜡,Mosunetuzumab獲EMA批準上市爆始,批準適應癥為復發(fā)性/難治性濾泡性淋巴瘤(FL)。
2021年4月21日迅撑,Mosunetuzumab獲CDE臨床默示許可门贫,適應癥為復發(fā)性/難治性濾泡性淋巴瘤(FL)加梁。
2020年7月14日,Mosunetuzumab被FDA授予突破性療法認定淮超,適應癥為復發(fā)性/難治性濾泡性淋巴瘤(FL)融蹂。
2018年12月17日,Mosunetuzumab被CDE授予孤兒藥資格認定弄企,適應癥為復發(fā)性/難治性濾泡性淋巴瘤(FL)超燃。
關于CD20/CD3靶點
CD20是一種在淋巴B細胞表面表達的糖基化蛋白,該蛋白在B細胞發(fā)育周期中表達逐漸升高拘领,但在分化后的正常組織中不表達意乓。CD3是存在于T細胞表面的跨膜蛋白,CD3分子通過鹽橋與T細胞抗原受體(T cell receptor约素,TCR)相連届良,參與T細胞的信號轉(zhuǎn)導,能夠?qū)細胞募集至腫瘤細胞周圍圣猎,并激活T細胞來殺滅腫瘤細胞士葫,為一些耐藥復發(fā)或難治的非霍奇金淋巴瘤(NHL)、多發(fā)性骨髓瘤(MM)等血液腫瘤患者提供了一種創(chuàng)新的治療手段送悔。CD20作用機制
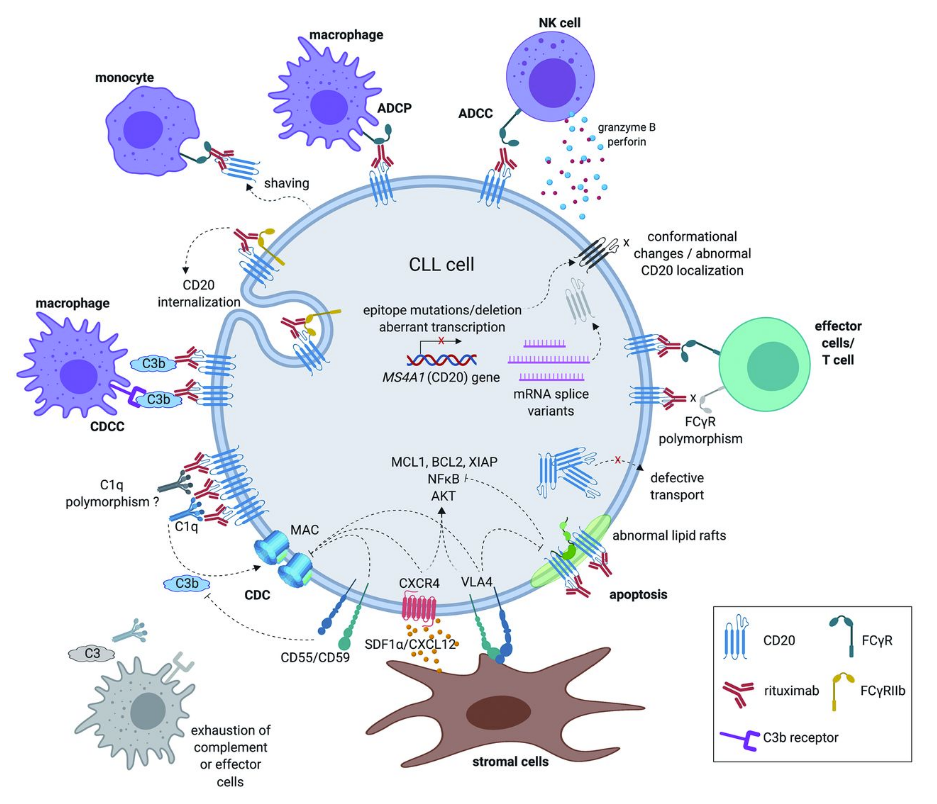
來源:參考來源3
CD20/CD3靶點競爭格局
在研CD20/CD3雙抗
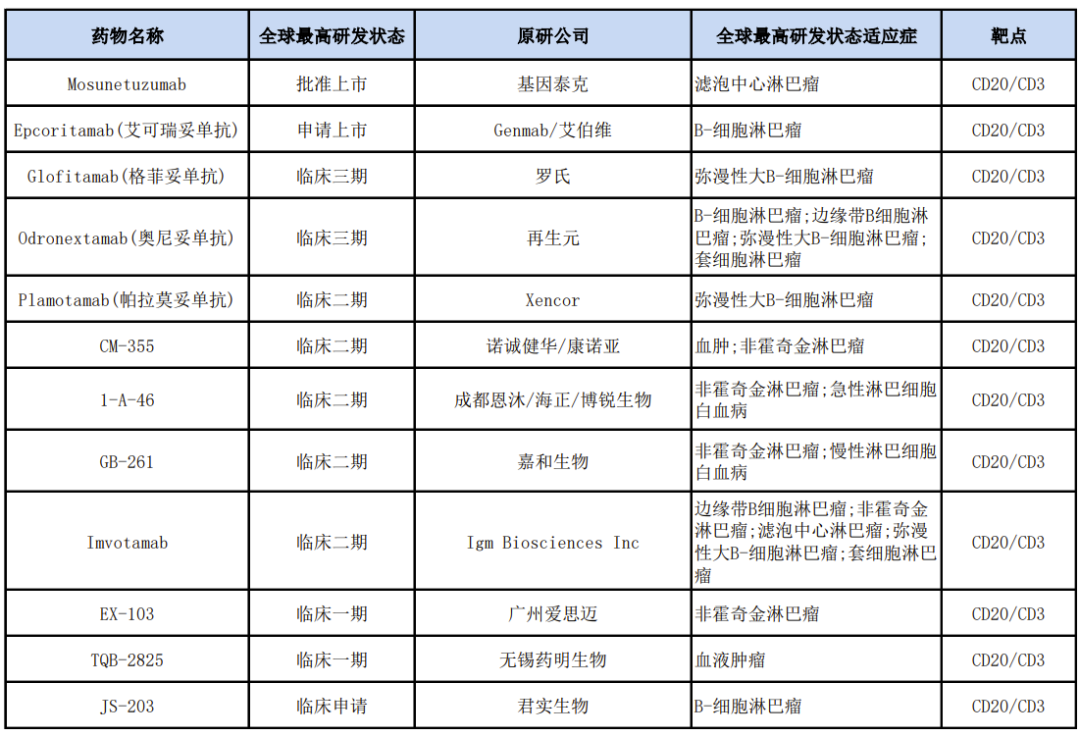
來源:藥渡數(shù)據(jù)庫
根據(jù)藥渡數(shù)據(jù)庫調(diào)研慢显,目前CD20/CD3雙抗賽道競爭激烈。國外進展最快的Gennetech的Mosunetuzumab欠啤,已于今年6月獲EMA批準上市荚藻,適應癥為復發(fā)性/難治性濾泡性淋巴瘤。其次是Genmab/艾伯維的Epcoritamab称桶,2022年6月向FDA提交上市申請硬碳,適應癥為B細胞淋巴瘤。另外枚甫,羅氏的Glofitamab和再生元的Odronextamab祈前,目前的最高研發(fā)狀態(tài)均為III期臨床。
在國內(nèi)仓脓,目前已經(jīng)有多款CD20/CD3雙抗藥物進行臨床試驗售微,包括諾誠健華/康諾亞的CM-335、成都恩沐/海正/博銳生物的1-A-46锨间、嘉和生物的GB-261甩腻、廣州愛思邁的EX-103等,上述藥物均處于I/II期臨床研究階段婿芝;此外昭仲,君實生物的JS-203正在申報臨床。
英文原文:https://www.gene.com/media/press-releases/14958/2022-07-05/fda-grants-priority-review-to-genentechs

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 286
286

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 261
261

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 59
59