
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2022-07-25
2022-07-25
 2391
2391
7月19日挎狸,Apellis宣布食店,美國FDA已受理玻璃體腔注射療法pegcetacoplan治療年齡相關(guān)性黃斑變性(AMD)繼發(fā)性地圖樣萎縮(GA)的新藥上市申請(NDA)并被納入了優(yōu)先審評跪倘,PDUFA日期定為2022年11月26日步鉴。另外胡野,F(xiàn)DA表示目前不打算召開咨詢委員會會議來討論該申請仁连。此消息一出满葛,Apellis股價上漲23.61%镰矿。

GA是年齡相關(guān)黃斑變性(AMD)的一種晚期病變琐驴,會導致不可逆轉(zhuǎn)的失明。全球約有500萬人患有GA秤标,且目前還沒有批準的治療方法绝淡。補體級聯(lián)反應(yīng)是一種天然的免疫調(diào)節(jié)方式,而過度的激活補體系統(tǒng)會導致GA不可逆的病變苍姜。C3是精準控制補體級聯(lián)反應(yīng)的靶點牢酵。Pegcetacoplan是一種靶向補體C3療法,旨在調(diào)節(jié)補體級聯(lián)的過度激活衙猪,進而控制疾病的發(fā)生發(fā)展馍乙。
該申請是基于III期DERBY和OAKS研究以及II期FILLY研究的積極結(jié)果。DERBY和OAKS分別有621垫释、637例患者入組丝格,分別接受每月、隔月注射pegcetacoplan或假處理對照組(sham組)治療饶号。主要終點為12個月時眼底自身熒光測量的GA病變總面積較基線的變化铁追。OAKS研究到達了主要終點,與sham組相比对轴,接受每月和隔月注射pegcetacoplan患者的GA病變面積分別減少了22%(p=0.0003)溺硼、16%(p=0.0052)。
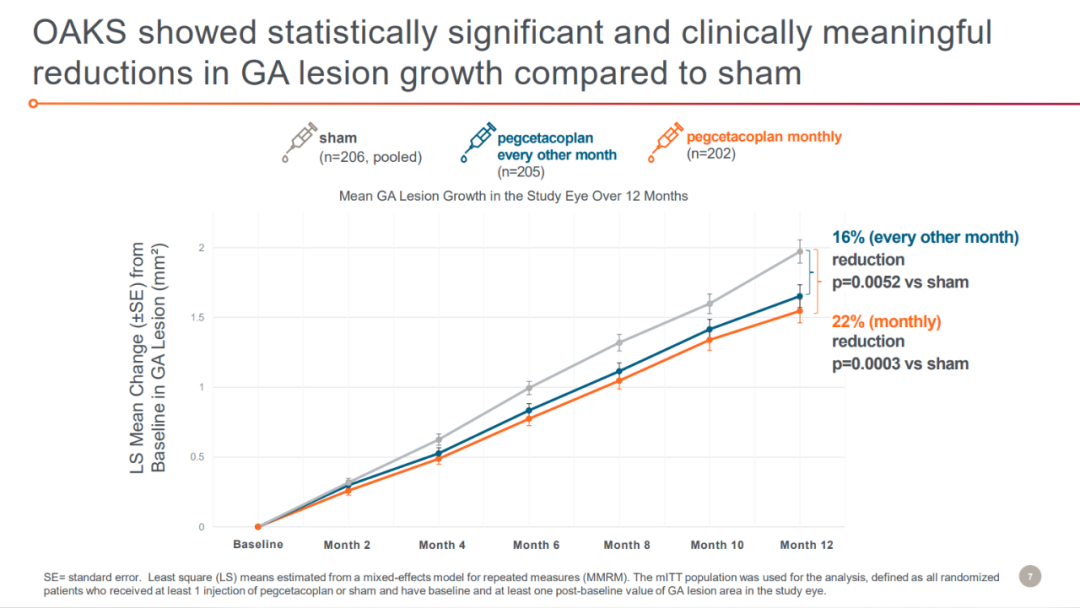
來源:Apellis
而DERBY研究未達到其主要終點亮史。
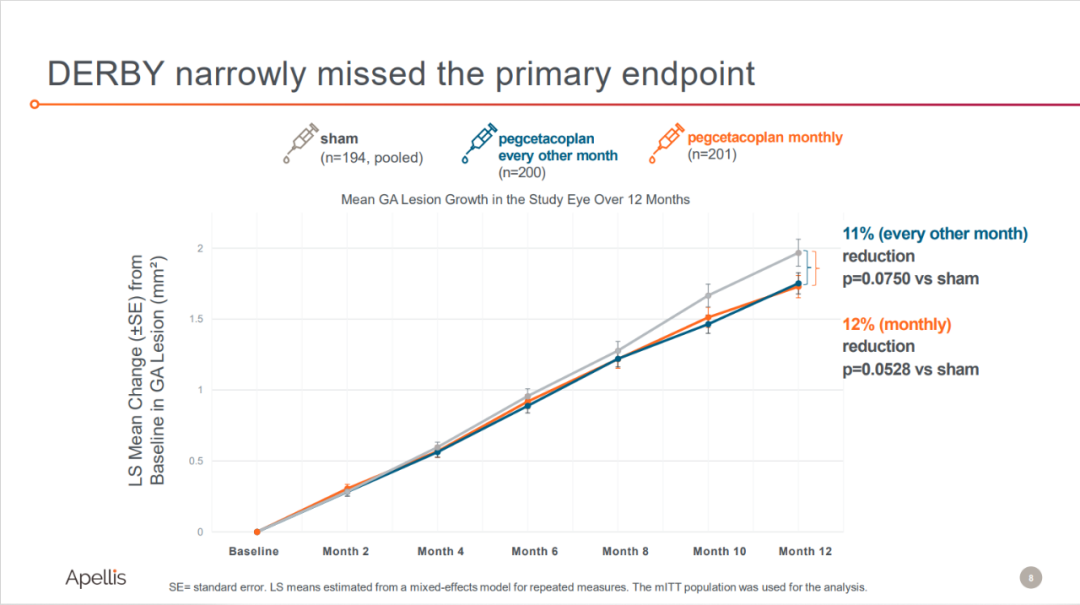
來源:Apellis
但DERBY和OKAS研究匯總結(jié)果顯示邪涕,接受每月和隔月注射pegcetacoplan患者的GA病變面積分別減少了17%(p<0.0001)茄溢、14%(p=0.0012);與未經(jīng)治療的對側(cè)眼相比椭集,注射pegcetacoplan治療也顯示出減緩GA病變速度的效果蝉狭。
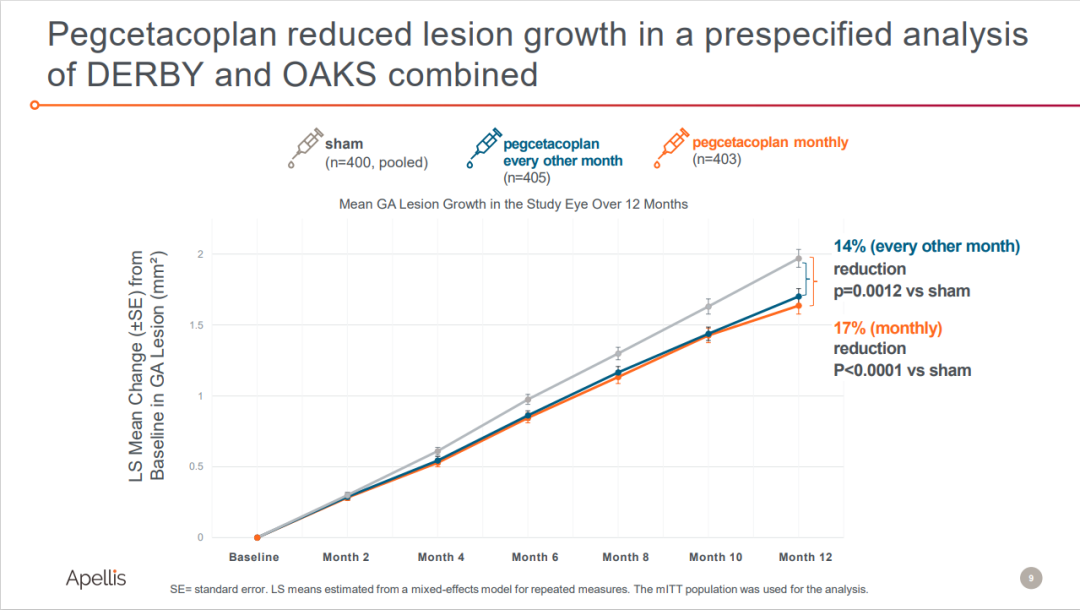
來源:Apellis
Pegcetacoplan已于2021年5月獲FDA批準并于同年12月獲得歐洲藥品管理局(EMA)批準上市,用于治療陣發(fā)性睡眠性血紅蛋白尿癥(PNH)咳龄。Apellis計劃在2022年下半年向EMA遞交治療GA的上市申請撞恰。
Apellis首席開發(fā)官Jeffrey Eisele博士說:“這是一個重要的里程碑,我們在不到兩年內(nèi)第二次讓FDA接受pegcetacoplan的NDA迎反,證明了pegcetacoplan針對C3靶向治療未滿足嚴重疾病的潛力审服。我們致力于與FDA密切合作,盡快為GA患者帶來這種潛在的旷似、前所未有的治療方法烤惊。“
原文鏈接
Apellis Announces FDA Acceptance and Priority Review of the New Drug Application for Pegcetacoplan for the Treatment of Geographic Atrophy (GA)

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 280
280

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 256
256

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 59
59