
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2022-08-01
2022-08-01
 3723
3723
7月26日,渤缴诳痢(Biogen)和Ionis pharmaceuticals共同宣布鸽凶,F(xiàn)DA已接受其在研反義寡核苷酸療法tofersen(BIIB067)的上市申請,用于治療超氧化物歧化酶1 (SOD1)突變所致的肌萎縮側(cè)索硬化(ALS)建峭。FDA同時授予其優(yōu)先審評資格玻侥,PDUFA日期定于2023年1月25日。
ALS是一種進行性神經(jīng)退行性疾病亿蒸,平均死亡時間為三至五年凑兰,最常見的死因是呼吸衰竭。SOD1-ALS是ALS的一種罕見遺傳性形式边锁,僅占全球約16.8萬ALS病例的2%姑食。目前,沒有針對ALS的基因靶向療法獲批窜旺。
Tofersen是一種用于治療SOD1-ALS的反義寡核苷酸藥物共悼。Tofersen可與編碼SOD1的mRNA結(jié)合,使其被核糖核酸酶降解杏紫,從而減少SOD1蛋白的產(chǎn)生钙瘫。
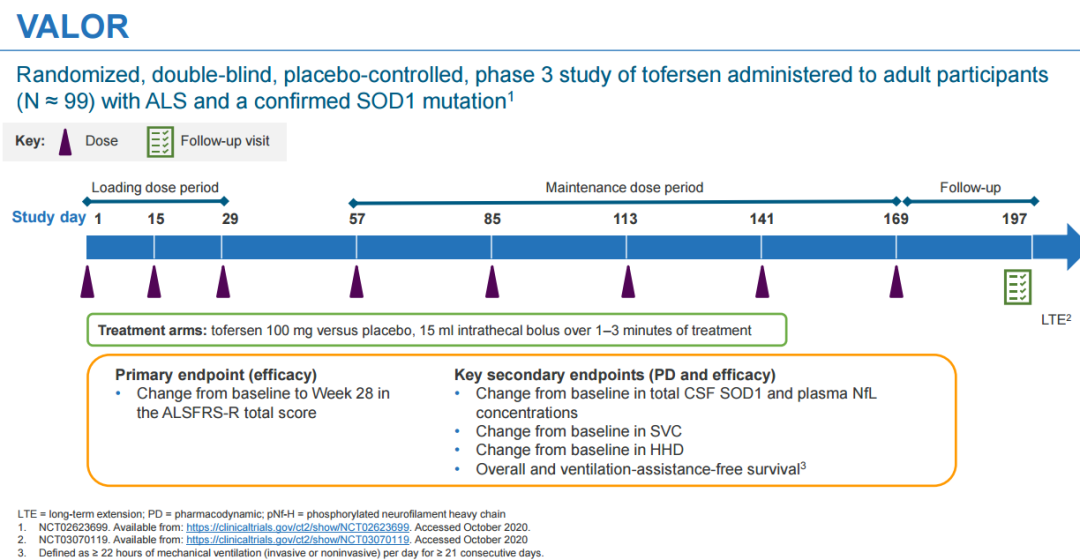
Tofersen的新藥申請包括在健康志愿者中的I期臨床試驗、I/II期多劑量爬坡(MAD)臨床試驗、III期臨床試驗VALOR以及開放標簽擴展 (OLE)的研究結(jié)果侯砸。同時也包含了最近12個月VALOR和OLE研究的整合結(jié)果挨奶,該研究最近在歐洲治愈ALS網(wǎng)絡(luò) (ENCALS) 年會上發(fā)表。 此前所公布的關(guān)鍵III期VALOR研究結(jié)果顯示俗衍,其并未達到修訂版肌萎縮側(cè)索硬化功能評定量表 (ALSFRS-R)中從基線到第28周評分變化差異的主要終點粥萍。然而,生物活性和臨床功能的多項次要和探索性終點分析顯示疾病進展有減緩的趨勢簸隅。近期公布的12個月整合性數(shù)據(jù)顯示犀挠,早期使用tofersen可持續(xù)減少神經(jīng)微絲(神經(jīng)退行性疾病的生物標志物)數(shù)目,且減緩許多療效終點的下降撰钥。
在此12個月的數(shù)據(jù)當中燎字,接受tofersen治療的患者最常見的不良反應(yīng)為頭痛、操作性疼痛阿宅、跌倒候衍、背痛與肢體疼痛等。VALOR和OLE中的大多數(shù)AE嚴重程度為輕度至中度洒放。約有6.7%的患者出現(xiàn)嚴重的神經(jīng)性相關(guān)事件蛉鹿,包含脊髓炎、神經(jīng)根炎往湿、無菌性腦膜炎與視神經(jīng)乳頭水腫妖异。
渤健的全球安全與監(jiān)管科學負責人兼臨時研發(fā)負責人Priya Singhal博士說道,“若是獲得批準领追,tofersen將會是第一個靶向ALS遺傳因子的療法随闺。我們希望這將會為此疾病的未來療法鋪路÷”

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 280
280

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 257
257

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 59
59