
 研發(fā)追蹤
研發(fā)追蹤
 Insight數(shù)據(jù)庫(kù)
Insight數(shù)據(jù)庫(kù)  2022-08-22
2022-08-22
 2195
2195
8 月 17 日,據(jù) FDA 官網(wǎng)顯示耙册,藍(lán)鳥(niǎo)生物(bluebird bio)基因療法 beti-cel 獲 FDA 批準(zhǔn)上市,用于治療需要定期輸血的成人和兒童 β-地中海貧血患者毫捣,單次治療費(fèi)用為 280 萬(wàn)美元详拙,超過(guò)諾華基因療法 Zolgensma 212.5 萬(wàn)美元的定位,成為「全球最貴藥物」蔓同。

來(lái)自:FDA
beti-cel 是美國(guó)首個(gè)獲批的針對(duì) β-地中海貧血患者潛在遺傳病因的一次性療法饶辙,將為患者提供常規(guī)紅細(xì)胞輸注和鐵螯合劑治療以外的替代方案蹲诀。
該療法的獲批是基于多項(xiàng) III 期研究的陽(yáng)性數(shù)據(jù),研究發(fā)現(xiàn)弃揽,89% (32/36) 所有年齡和基因型的可評(píng)估患者(包括年僅 4 歲的兒童和最嚴(yán)重基因型 (β0/β0) 患者)均實(shí)現(xiàn)了輸血獨(dú)立(至少 12 個(gè)月不再需要 RBC 輸注管员,同時(shí)保持至少 9g/dL平均 Hb 水平)。
本次在美國(guó)獲批上市商品名為 Zynteglo巷卵,與此前在歐洲上市時(shí)商品名一致溅逃。據(jù) Insight數(shù)據(jù)庫(kù) 顯示,beti-cel 在 2019 年 5 月在歐盟獲批上市任肯,不過(guò) 2021 年 4 月藍(lán)鳥(niǎo)生物已經(jīng)宣布從德國(guó)撤市额晶,后續(xù)投資者交流中又表示將在 2022 年初從歐洲市場(chǎng)撤出演湘,原因與定價(jià)相關(guān)绿窿。
beti-cel 的臨床開(kāi)發(fā)跨越近 10 年,該藥在美國(guó)的審評(píng)延遲并非來(lái)自于安全性問(wèn)題窃裙,而是由于 CMC 問(wèn)題纹轩。ICER 在今年早些時(shí)候曾給出了積極評(píng)價(jià),認(rèn)為若以 210 萬(wàn)美元定價(jià)宦噩,該療法具有成本效益缅科,畢竟相較于持續(xù)輸血治療,基因療法是一種一次性治療方案衰拄。因此耗跛,此前業(yè)內(nèi)對(duì)該藥前景的推測(cè)更加積極。
而本次確定定價(jià)為 280 萬(wàn)美元攒发,更是彰顯其在臨床研究中證明的強(qiáng)大而持續(xù)的臨床益處调塌,以及其在減輕與定期 RBC 輸血和鐵管理相關(guān)的終生醫(yī)療保健成本方面的潛力。
Zynteglo 的研發(fā)歷程
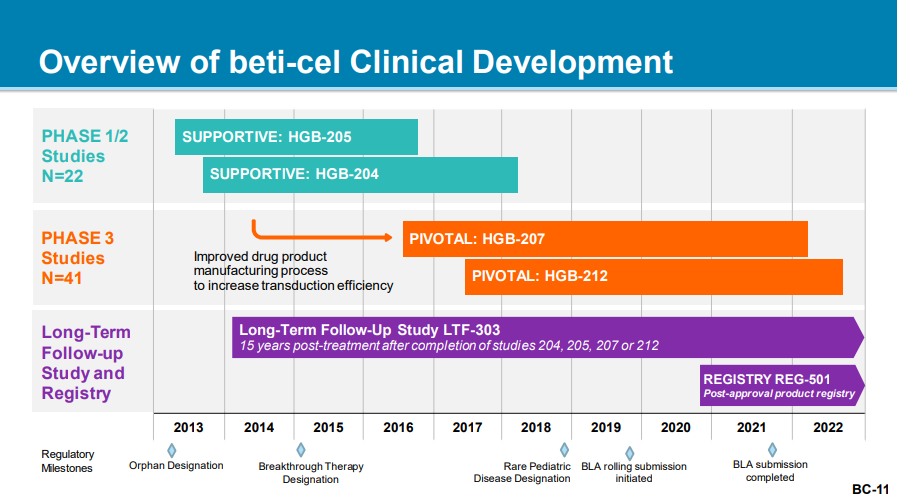
來(lái)自:FDA 官方材料
除 beti-cel 外惠猿,目前藍(lán)鳥(niǎo)生物管線(xiàn)中有另一款核心產(chǎn)品 Eli-cel(Skysona)羔砾,同樣備受關(guān)注。
腎上腺腦白質(zhì)營(yíng)養(yǎng)不良(ALD)是一種罕見(jiàn)的 X 染色體連鎖代謝疾病偶妖,由 ABCD1 基因突變所致姜凄。該突變會(huì)影響腎上腺腦白質(zhì)營(yíng)養(yǎng)不良蛋白(ALDP)的產(chǎn)生,隨之導(dǎo)致超長(zhǎng)鏈脂肪酸(VLCFAs)在腎上腺皮質(zhì)以及腦和脊髓的白質(zhì)中的毒性聚集趾访。
約 40% 的 ALD 患者將發(fā)展至腦性腎上腺腦白質(zhì)營(yíng)養(yǎng)不良(CALD)态秧,其癥狀常出現(xiàn)在幼年早期,且進(jìn)展迅速扼鞋。若不加以治療屿聋,大多數(shù)患者面臨神經(jīng)功能?chē)?yán)重受損、乃至最終死亡的結(jié)局藏鹊。
藍(lán)鳥(niǎo)生物的 eli-cel(elivaldogene autotemcel)是首個(gè)針對(duì) CALD 開(kāi)發(fā)的一次性基因療法润讥。通過(guò)將 ABCD1 基因的功能性拷貝轉(zhuǎn)導(dǎo)至患者自身造血干細(xì)胞(CD34+)碎师,使患者自身細(xì)胞可以產(chǎn)生功能性的 ALDP 蛋白,從而清除因 VLCFA 堆積導(dǎo)致 CALD 中的神經(jīng)變性跛脾。
據(jù) Insight 數(shù)據(jù)庫(kù) 顯示批贴,eli-cel 的臨床研發(fā)已經(jīng)歷經(jīng)至少十年。2021 年 7 月癣跟,eli-cel 獲 EMA 批準(zhǔn)在歐洲上市用噪,商品名為 Skysona。遺憾的是景顷,eli-cel 在歐洲商業(yè)化歷程并不順利誓籽,上市不到三個(gè)月,藍(lán)鳥(niǎo)生物就宣布由于商業(yè)策略原因決定退出歐洲市場(chǎng)强男,放棄了歐盟 EMA 和英國(guó) MHRA 對(duì) Skysona 的監(jiān)管批準(zhǔn)洪业。這一決定可能與定價(jià)溝通不順有一定關(guān)系,同期藍(lán)鳥(niǎo)的另一款新藥 beti-cel 與德國(guó)政府談判失敗而撤出德國(guó)眨仪。
隨著歐洲市場(chǎng)商業(yè)化不順峭桅,藍(lán)鳥(niǎo)生物基因療法的商業(yè)化重心也隨之轉(zhuǎn)向美國(guó)。
eli-cel 研發(fā)歷程甘特圖(Insight)
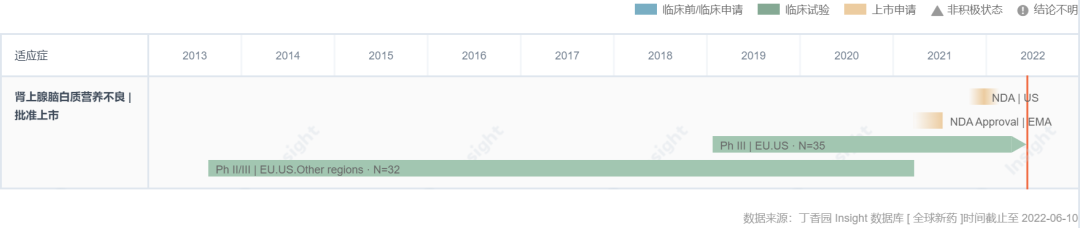
來(lái)自:Insight 數(shù)據(jù)庫(kù) (http://db.dxy.cn/v5/home/)
然而 2021 年初柑爸,安全性隱憂(yōu)開(kāi)始逐漸浮現(xiàn)吵护。2 月份,F(xiàn)DA 暫停了 lovo-cel 針對(duì) 18 歲以下鐮狀細(xì)胞病患者的臨床試驗(yàn)表鳍,原因是 2 例患者發(fā)展為急性髓性白血蚕诙(AML)。lovo-cel 和 beti-cel 為 LentiGlobin? 針對(duì)不同適應(yīng)癥開(kāi)發(fā)的療法譬圣,前者針對(duì)鐮狀細(xì)胞病瓮恭,后者針對(duì) β 地中海貧血。不過(guò)針對(duì)這一事件胁镐,藍(lán)鳥(niǎo)生物在調(diào)查后表示不太可能與其慢病毒載體(LLV)相關(guān)偎血。
同年 8 月,在 eli-cel 的臨床試驗(yàn)中盯漂,1 例接受 eli-cel 治療的患者被診斷患上骨髓增生異常綜合征(MDS)颇玷,這種疾病最終會(huì)發(fā)展為急性髓系白血病(AML)就缆,因而意味著 eli-cel 潛在可能帶來(lái)致癌風(fēng)險(xiǎn)帖渠。經(jīng)藍(lán)鳥(niǎo)生物調(diào)查,MDS 的發(fā)生是由于慢病毒載體(LVV)整合入患者基因組所致资担。FDA 隨即要求藍(lán)鳥(niǎo)生物暫停了相應(yīng)臨床試驗(yàn)旬效。12 月,該藥的上市審評(píng)也遭遇延期踱孕,PDUFA 決定日期在 2022 年 9 月 16 日讯匈。
在今年 6 月份美國(guó) FDA 召開(kāi)細(xì)胞艾蜓、組織和基因治療咨詢(xún)委員會(huì)(CTGTAC)會(huì)議上,咨詢(xún)委員會(huì)的專(zhuān)家們對(duì) eli-cel 表現(xiàn)出更積極的態(tài)度策坏。13 位專(zhuān)家認(rèn)為 lovo-cel 的安全性問(wèn)題不影響對(duì) eli-cel 安全性的評(píng)估零反,1 位專(zhuān)家認(rèn)為兩者相關(guān),1 位專(zhuān)家棄權(quán)烈肉;此外迫讨,參與投票的 15 位專(zhuān)家均認(rèn)可 eli-cel 的獲益大于風(fēng)險(xiǎn)。

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 281
281

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 258
258

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 59
59
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽