
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2022-08-22
2022-08-22
 2126
2126
8月18日雾棺,安斯泰來(lái)公告宣布,神經(jīng)激肽3受體拮抗劑fezolinetant的新藥上市申請(qǐng)(NDA)已獲FDA受理并獲優(yōu)先審查認(rèn)定简烘,PDUFA日期定為2023年2月22日换怖。本次申請(qǐng)的適應(yīng)癥為與更年期相關(guān)的中度至重度血管舒縮癥狀(VMS)甩恼。一旦獲批,fezolinetant將成為首款治療VMS的非激素療法沉颂。

VMS是最常見(jiàn)的更年期相關(guān)癥狀条摸,常表現(xiàn)為潮熱或盜汗,50%以上40至64歲的女性受其影響铸屉。三分之一的女性在絕經(jīng)后的十多年中持續(xù)經(jīng)歷中度至重度的潮熱癥狀钉蒲。目前主要治療手段仍是激素替代療法(HRT),已有超過(guò)10種激素類單藥及組合療法用于該病彻坛。短期內(nèi)使用激素治療是有效且安全的顷啼,但長(zhǎng)此以往會(huì)增加靜脈血栓栓塞風(fēng)險(xiǎn)。
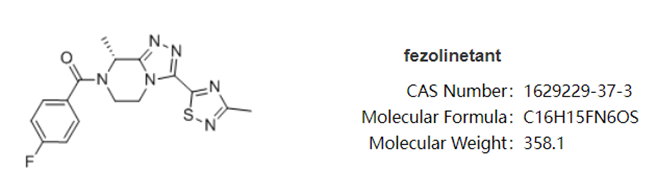
fezolinetant(非唑奈坦)是安斯泰來(lái)自主研發(fā)的一款選擇性神經(jīng)激肽3受體(NK3)拮抗劑昌屉,主要通過(guò)阻斷NKB與KNDy神經(jīng)元的結(jié)合线梗,調(diào)節(jié)下丘腦體溫調(diào)節(jié)中樞的神經(jīng)元活動(dòng),從而治療與更年期相關(guān)的VMS怠益。
FDA此次受理是基于兩項(xiàng)關(guān)鍵III期臨床試驗(yàn)(Skylight 1和Skylight 2)及一項(xiàng)長(zhǎng)期安全性研究(Skylight 4)的結(jié)果仪搔。
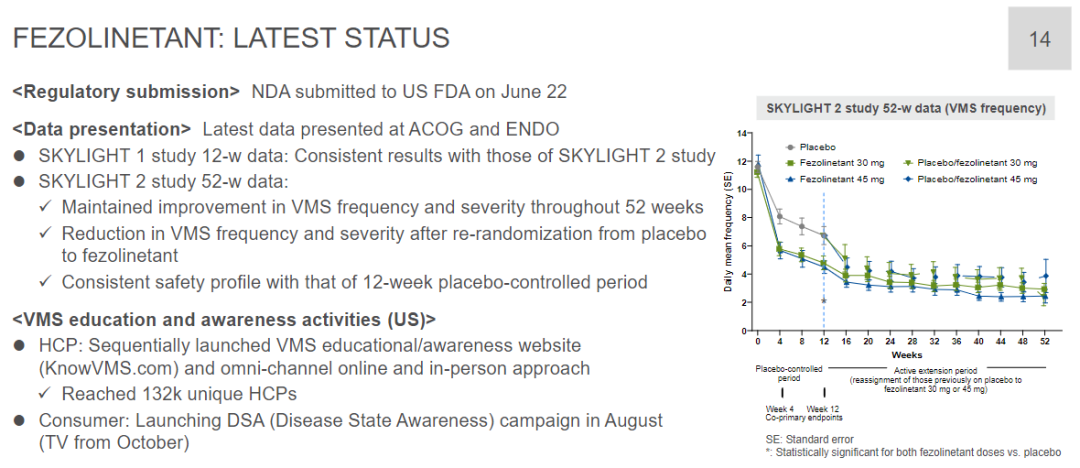
Skylight 1和Skylight 2均是隨機(jī)、雙盲团春、安慰劑對(duì)照研究袄扛,分別納入了527例和507例患者,旨在評(píng)估fezolinetant治療與更年期相關(guān)的中度至重度血管舒縮癥狀女性患者的療效和安全性兔卤。共同的主要終點(diǎn)為第4周和第12周時(shí)中度至重度VMS平均頻率和嚴(yán)重程度的變化桂付。
結(jié)果顯示,在第4周和第12周云盲,與安慰劑組相比巍嘶,fezolinetant組患者發(fā)生中度至重度VMS的頻率顯著降低且嚴(yán)重程度顯著減輕。此外球逢,fezolinetant具有良好的安全性原承,發(fā)生嚴(yán)重治療緊急不良事件(TEAE)的概率較低(不超過(guò)2%),最常見(jiàn)的不良反應(yīng)是頭痛。
Skylight 4是一項(xiàng)隨機(jī)废奖、雙盲鞍后、安慰劑對(duì)照III期臨床試驗(yàn),共納入1831例患者内地,旨在評(píng)估fezolinetant對(duì)患者子宮內(nèi)膜健康的影響及長(zhǎng)期安全性和耐受性伴澄。主要終點(diǎn)是第52周時(shí)子宮內(nèi)膜增生和子宮內(nèi)膜癌的患者比例和第55周時(shí)不良反應(yīng)發(fā)生率及其嚴(yán)重程度。結(jié)果顯示阱缓,研究達(dá)到評(píng)估子宮內(nèi)膜健康狀況的主要終點(diǎn)非凌,最常見(jiàn)的不良事件為頭痛和新冠病毒感染,與安慰劑一致荆针。
安斯泰來(lái)高級(jí)副總裁兼開(kāi)發(fā)治療領(lǐng)域負(fù)責(zé)人Ahsan Arozullah博士說(shuō):“FDA接受fezolinetant的NDA使我們離為經(jīng)歷VMS的美國(guó)女性帶來(lái)新療法更近了一步清焕。我們期待FDA對(duì)本次申請(qǐng)進(jìn)行審查,并期待帶來(lái)首款非激素類藥物以減少與更年期相關(guān)的中度至重度VMS的頻率和嚴(yán)重程度祭犯〗胀祝”

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 277
277

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 253
253

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 59
59
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽