
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2022-08-29
2022-08-29
 2377
2377
8月22日凯旭,Minerva Neurosciences公告宣布已向FDA提交roluperidone的新藥申請(qǐng)(NDA)属提,用于治療精神分裂癥患者的陰性癥狀。

精神分裂癥是最嚴(yán)重的精神疾病之一病往,主要表現(xiàn)為思維捣染、感知、情緒饭糊、語言豌泊、認(rèn)知和行為等多方面存在異常,影響全球2000萬人稳虱。其中怔于,陰性癥狀指的是精神功能的減退或缺失,主要包括情感遲鈍畅刑、情緒低落姚详、意志缺乏、性欲減退和社交能力降低喇躲。目前腮稚,美國(guó)尚無針對(duì)精神分裂癥陰性癥狀的療法。
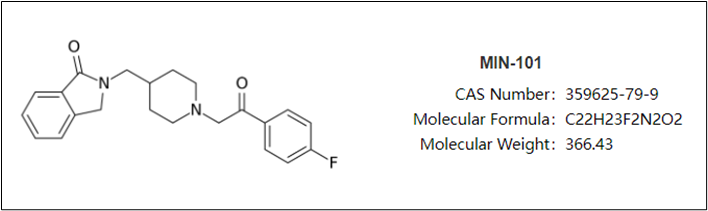
roluperidone是一款5-HT2A受體和σ2受體拮抗劑继棉,最初由Mitsubishi Tanabe公司開發(fā)挽饺。2007年8月,Minerva Neurosciences與Mitsubishi Tanabe達(dá)成許可協(xié)議终琅,獲得roluperidone在除中國(guó)恨溜、日本、印度和韓國(guó)等亞洲國(guó)家以外地區(qū)的獨(dú)家開發(fā)和商業(yè)化權(quán)益找前。
本次NDA是基于兩項(xiàng)III期臨床試驗(yàn)(MIN-101C03和MIN-101C07)的積極結(jié)果糟袁。MIN-101C03研究是一項(xiàng)全球性、多中心、隨機(jī)系吭、雙盲五嫂、安慰劑對(duì)照試驗(yàn),共納入515例患者肯尺,旨在評(píng)估roluperidone兩種劑量規(guī)格(32mg和64mg)治療精神分裂癥的中度至重度陰性癥狀和穩(wěn)定陽性癥狀的患者的療效和安全性沃缘。主要終點(diǎn)為第12周時(shí)Marder陰性癥狀因素評(píng)分(NSFS)的變化。MIN-101C07研究是MIN-101C03研究的擴(kuò)展研究则吟,共納入333例患者槐臀,主要終點(diǎn)為第40周時(shí)NSFS的變化。
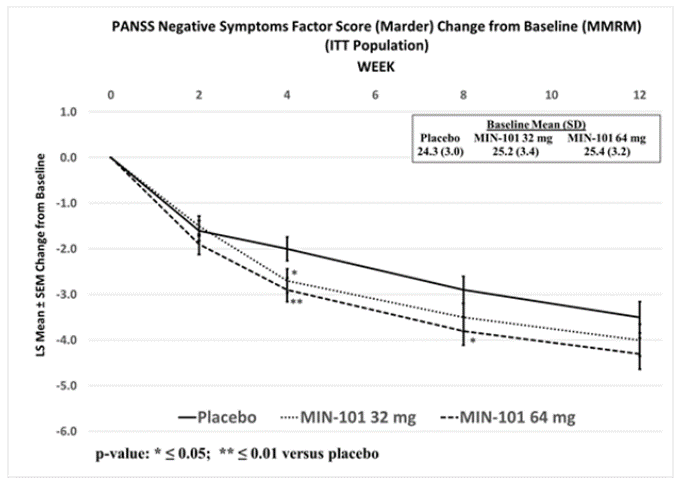
MIN-101C03研究的結(jié)果顯示氓仲,在第12周水慨,roluperidone組患者的NSFS評(píng)分改善顯著優(yōu)于安慰劑組。
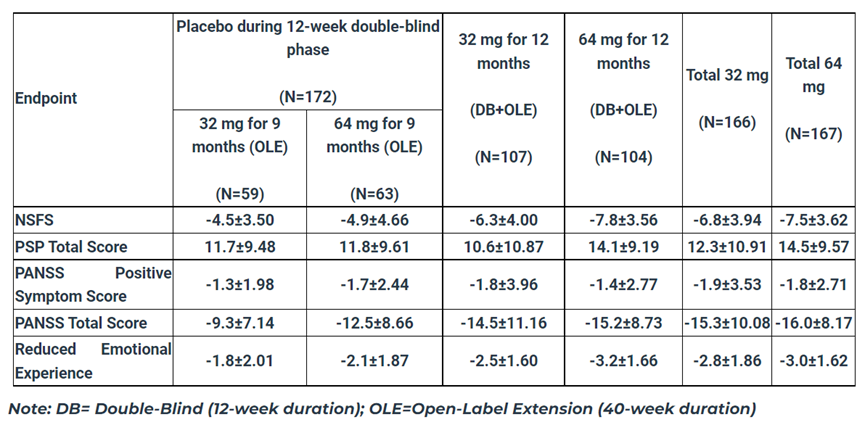
MIN-101C07研究的結(jié)果顯示敬扛,第40周時(shí)现熔,在改良意向性治療(mITT)人群中,roluperidone(64mg)組患者的NSFS評(píng)分改善(p≤0.044)和個(gè)人和社會(huì)表現(xiàn)(PSP)總分改善(p≤0.017)均顯著優(yōu)于安慰劑組滤躺。
執(zhí)行主席兼首席執(zhí)行官Remy Luthringer說:“我們相信roluperidone可能代表了一種新的治療選擇展霸,用于治療精神分裂癥陰性癥狀患者。目前美國(guó)沒有相關(guān)療法獲批屠途。精神分裂癥的陽性癥狀通齿杭。可以通過服用抗精神病藥物得到很好的控制,但陰性癥狀是該疾病的主要負(fù)擔(dān)且會(huì)對(duì)患者的職業(yè)和社交技能造成負(fù)面影響带诊,降低他們的生活質(zhì)量辈喜。我們要向所有參與roluperidone臨床研究的患者、護(hù)理人員和研究人員以及工作人員表示衷心的贊賞和感謝于箩。在2022年3月召開C類會(huì)議后砖伴,我們一直在與FDA進(jìn)行溝通,且期待與FDA在本次審查過程中合作羹圣“苍粒”

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 278
278

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 254
254

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 59
59
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽