
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2022-09-26
2022-09-26
 3227
3227
9月21日谣辞,禮來宣布谤饭,Retevmo(selpercatinib谷暮,塞爾帕替尼)新適應(yīng)癥獲FDA加速批準筷厘,用于治療轉(zhuǎn)染重排(RET)基因融合的局部晚期或轉(zhuǎn)移性實體瘤患者么鸿,這些患者在接受前期系統(tǒng)性治療后發(fā)生疾病進展吉恍,或沒有其它滿意的替代治療選擇籍胯。這是全球首個且唯一一個不限癌種用于治療RET基因融合實體瘤的RET抑制劑竟闪。

此外,F(xiàn)DA還拓寬了selpercatinib治療非小細胞肺癌的適應(yīng)癥范圍杖狼,納入局部晚期疾病患者炼蛤,并將2020年5月對NSCLC的加速批準轉(zhuǎn)為完全批準。
本次FDA的批準主要基于I/II期LIBRETTO-001試驗的ORR和DoR結(jié)果蝶涩。研究納入了初治患者和經(jīng)治的各種晚期實體腫瘤患者理朋,包括RET融合陽性的NSCLC、RET突變的MTC绿聘、RET融合陽性的甲狀腺癌以及其它RET改變的實體腫瘤嗽上,共702例次舌。
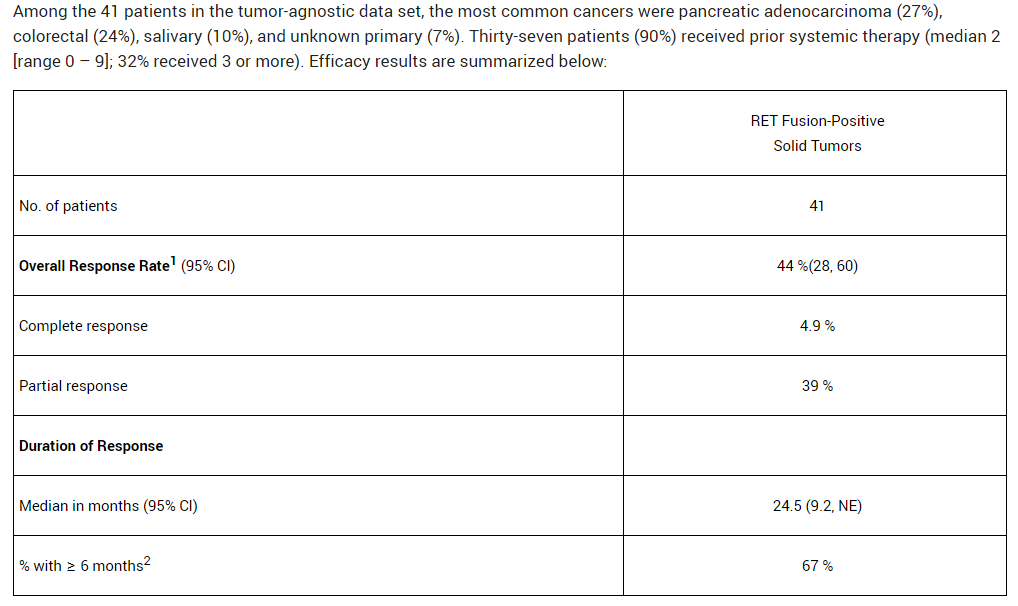
在41名RET陽性實體瘤受試者中的結(jié)果如下,客觀緩解率為44%兽愤,中位緩解持續(xù)時間為24.5個月彼念,67%的患者緩解持續(xù)時間超過6個月。
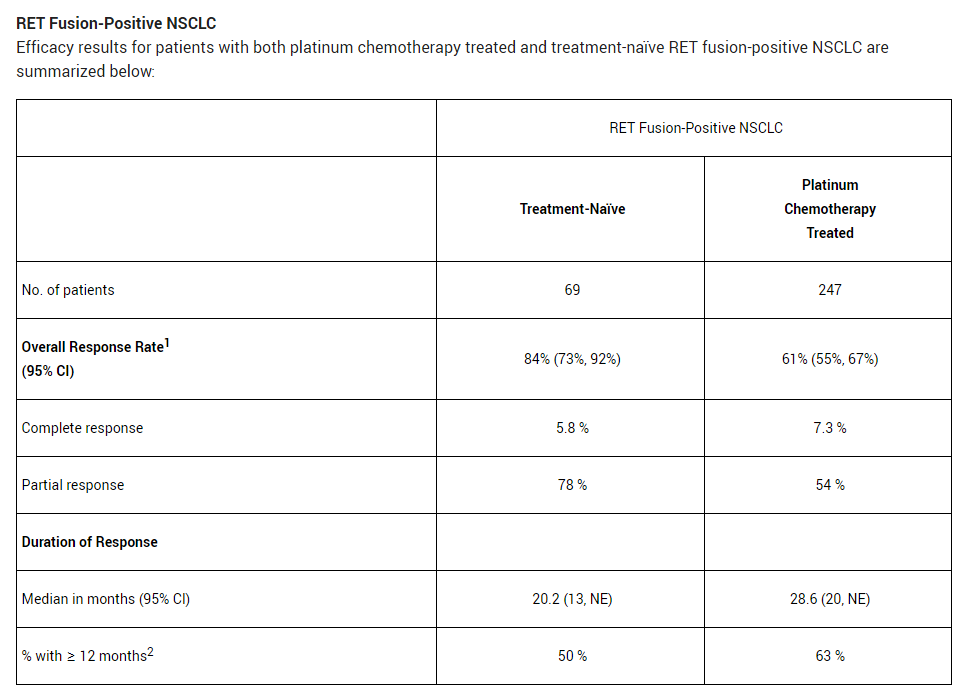
在初治或接受含鉑治療的RET融合陽性NSCLC患者中結(jié)果如下烹看,ORR分別為84%和61%国拇,中位緩解持續(xù)時間分別為20.2個月和28.6個月,緩解持續(xù)時間超過12個月的患者比例分別為50%和63%郭宪。
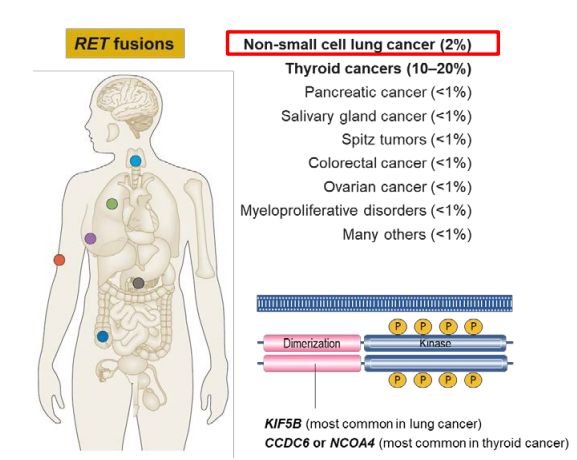
RET融合和突變發(fā)生在多種腫瘤類型中燃灿,包括肺癌、甲狀腺癌以及其他一些腫瘤類型中息扶。據(jù)估計敦璧,RET基因融合在NSCLC患者中的發(fā)生率約為1%~2%,在甲狀腺乳頭狀癌(占所有甲狀腺癌的85%左右)中的發(fā)生率為10%~20%纫脚,在甲狀腺髓樣癌中的發(fā)生率為60%左右钻琴。
Selpercatinib是Loxo Oncology開發(fā)的一種高選擇性和有效的轉(zhuǎn)染重排基因(RET)抑制劑。2019年1月况颈,禮來花費80億美元收購Loxo Oncology公司堕圾,從而獲得了該靶向療法。
2020年5月8日勾奇,F(xiàn)DA加速批準selpercatinib上市谁昵,成為首個獲批靶向RET的腫瘤療法,用于治療成人轉(zhuǎn)移性RET融合陽性非小細胞肺癌(NSCLC)摆野、成人及12歲以上兒童需要全身治療的晚期或轉(zhuǎn)移性RET突變髓樣甲狀腺癌(MTC)和需要全身治療且放射性碘耐受(如適當)的晚期或轉(zhuǎn)移性RET融合陽性甲狀腺癌患者的療法夭寺。2021年8月,中國藥監(jiān)局受理了selpercatinib用于上述適應(yīng)癥的新藥上市申請裆站,并授予優(yōu)先審評資格条辟。
2022年3月,禮來和信達生物達成協(xié)議宏胯,授予后者在中國大陸進口羽嫡、銷售、推廣和分銷雷莫西尤單抗和Selpercatinib獲批后獨家商業(yè)化權(quán)利肩袍。Selpercatinib在2021年的全球銷售額為1.147億美元厂僧,相比2020年(0.366億美元)有較大提升。2022年上半年了牛,該藥物的銷售額為0.868億美元颜屠。

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 279
279

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 255
255

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 59
59