
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2022-11-28
2022-11-28
 2545
2545
argenx今日宣布美國FDA接受其efgartigimod皮下注射制劑修梭,用于治療全身性重癥肌無力(gMG)成人患者的生物制品許可申請(qǐng)(BLA)配亮,并授予優(yōu)先審評(píng)資格。FDA預(yù)計(jì)于2023年3月20日完成審查貌硬。
重癥肌無力是一種罕見的慢性自身免疫性疾病用堤。患者體內(nèi)的IgG抗體會(huì)破壞神經(jīng)和肌肉之間的溝通嚣褐,引起虛弱和可能危及生命的肌無力萌烁。超過85%的患者在發(fā)病后18個(gè)月內(nèi)進(jìn)展為全身性重癥肌無力,進(jìn)而導(dǎo)致極度疲勞和面部表情逸茅、言語绎儡、吞咽和活動(dòng)困難。
Efgartigimod是一款靶向Fc受體(FcRn)的“first-in-class”療法详不。其靜脈輸注(IV)制劑Vyvgart(efgartigimod alfa-fcab)在去年12月獲批蚯氯,成為首個(gè)FDA批準(zhǔn)的FcRn阻斷劑。Efgartigimod可減少致病性IgG抗體妖救,阻斷IgG再循環(huán)過程橄浓。FcRn受體的作用是防止IgG的降解,因此通過防止IgG與FcRn的結(jié)合亮航,能夠?qū)е陆閷?dǎo)自身免疫性疾病的IgG抗體更快耗竭荸实,從而減輕疾病癥狀。再鼎醫(yī)藥已與argenx公司達(dá)成合作缴淋,獲得這款創(chuàng)新療法在大中華區(qū)的開發(fā)和商業(yè)化權(quán)益准给。
Efgartigimod皮下注射制劑包含重組人透明質(zhì)酸酶PH20(rHuPH20)。rHuPH20由Halozyme Therapeutics公司開發(fā)宴猾,它可以降解體內(nèi)的透明質(zhì)酸圆存,以幫助皮下注射藥物的滲透和吸收,為患者提供額外的治療選擇仇哆。
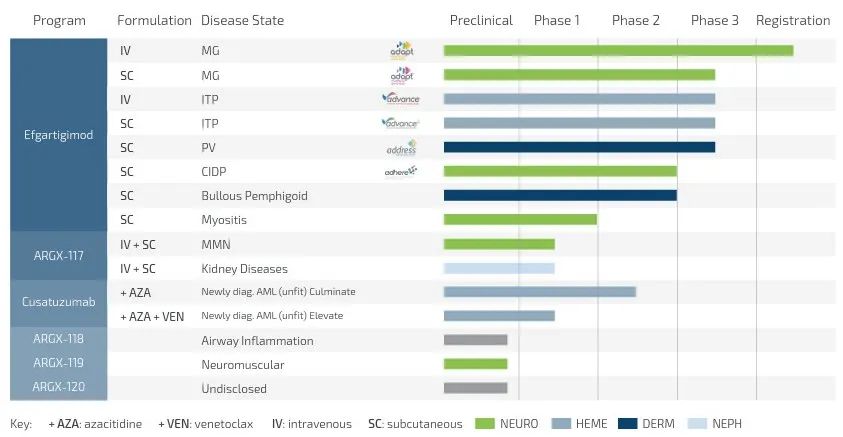
▲argenx公司研發(fā)管線(圖片來源:argenx公司官網(wǎng))
這次申請(qǐng)遞交是基于ADAPT-SC臨床3期試驗(yàn)的結(jié)果沦辙。該試驗(yàn)在110位成人gMG患者中評(píng)估了efgartigimod皮下注射制劑與靜脈輸注制劑相比的藥效學(xué)作用。試驗(yàn)達(dá)到了非劣效性標(biāo)準(zhǔn)的主要終點(diǎn)(p<0.0001)讹剔,皮下注射制劑組第29天的平均總IgG水平相對(duì)基線降低66.4%油讯,而靜脈輸注制劑組為62.2%。此外延欠,試驗(yàn)還達(dá)到其他關(guān)鍵次要終點(diǎn)陌兑,與在靜脈輸注制劑3期臨床試驗(yàn)中觀察到的臨床療效結(jié)果一致却师,包括重癥肌無力日常生活活動(dòng)(MG-ADL)和定量重癥肌無力(QMG)等評(píng)分的改善。其安全性特征也與以往研究一致素司,通常耐受性良好程押,最常見的不良事件是注射部位反應(yīng)(ISR)。
“FDA接受我們BLA是完成我們拓展gMG患者療法以協(xié)助每位病患經(jīng)歷這項(xiàng)衰弱性疾病的重要一步押逾。我們對(duì)于gMG患者能夠有機(jī)會(huì)通過多種方式接受不同劑量的治療感到興奮果派,”argenx的首席運(yùn)營官Keith Woods先生說道,“有了確切的PDUFA日期眶洗,我們正在準(zhǔn)備推出我們第二項(xiàng)商業(yè)化產(chǎn)品蟀披,我們期待有機(jī)會(huì)為gMG患者再推出另一項(xiàng)治療選項(xiàng)〉掏”

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 269
269

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 246
246

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 58
58
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽