
 研發(fā)追蹤
研發(fā)追蹤
 生物谷
生物谷  2022-11-28
2022-11-28
 3743
3743
Tzield(teplizumab)是第一種可預防/延緩高危人群發(fā)展為臨床1型糖尿惨种睢(T1D)的療法攒暇。2周療程治療將疾病風險降低50%咆上、發(fā)病推遲25個月(2年)待侵。
2022年11月17日訊 /生物谷BIOON/ --Provention Bio是一家致力于攔截和預防免疫介導性疾病的生物制藥公司颗胡。近日疙岂,該公司宣布损侄,美國食品和藥物管理局(FDA)已批準Tzield(teplizumab-mzwv)注射液:該藥是一種靜脈注射的抗CD3單抗找田,作為第一種也是唯一一種免疫調節(jié)療法歌憨,用于目前患有2期1型糖尿沧藕(T1D)的成人和兒童患者(≥8歲),延緩3期T1D(臨床T1D)的發(fā)病务嫡。用藥方面甲抖,Tzield連續(xù)14天每天靜脈輸注一次。
值得一提的是心铃,Tzield是第一種可預防/延緩特定人群發(fā)展為臨床T1D(3期T1D)的療法准谚,這是繼一個世紀前胰島素問世以來,T1D治療方面取得的第一個重大進展去扣。來自關鍵性TN-10研究數(shù)據(jù)顯示柱衔,在病程處于2期的T1D癥狀前患者中,與安慰劑相比愉棱,單個為期2周(14天)療程的Tzield治療唆铐,將胰島素依賴性臨床期疾病(3期T1D)的中位診斷時間延遲了25個月或約2年(50個月 vs 25個月)奔滑,這代表著3期T1D發(fā)病時間在統(tǒng)計學上顯著延長艾岂。
Tzield是用于T1D的第一種疾病修正療法。T1D是一種危及生命的自身免疫性疾病迈壤。2期T1D定義為存在2種或多種T1D相關自身抗體和血糖代謝障礙嚎衡。3期T1D的發(fā)病是一個改變生命的時刻,進展至3期T1D的患者玉桅,最終需要終生注射胰島素漓荞。3期T1D與嚴重的健康風險相關,包括危及生命的糖尿病酮癥酸中毒掷锻。
Tzield通過優(yōu)先審查程序獲得批準拟卢,之前已被授予突破性療法認定(BTD)。目前蔑来,Tzield也正在接受歐洲藥品管理局(EMA)的審查绞甥。在歐盟,Tzield之前被授予了優(yōu)先藥物資格(PRIME)澈虱。PRIME是EMA推出的一個快速審批項目帖豫,與美國FDA的BTD項目相似,旨在加速醫(yī)藥短缺領域重點藥品的審評進程表牲。
FDA藥物評估與研究中心糖尿病镜伪、血脂紊亂和肥胖部主任John Sharretts表示:“今天批準的首創(chuàng)(first-in-class)療法為某些高危T1D患者帶來了一個重要的新治療選擇。該藥延遲1型糖尿蚕牖谩(T1D)臨床診斷的潛力粱栖,可能會為患者提供數(shù)月至數(shù)年的無疾病負擔。”
2022年10月闹究,Provention Bio宣布與賽諾菲就美國推出Tzield達成聯(lián)合推廣協(xié)議幔崖,以延緩高危人群臨床T1D的發(fā)病。賽諾菲美國全科醫(yī)學主管Olivier Bogillot表示:“這一批準對糖尿病界來說是一個意義深遠且期待已久的勝利渣淤。我們贊揚Proventio Bio堅定不移的決心赏寇,為患者帶來了有史以來第一種T1D疾病修正療法。我們期待利用賽諾菲在內分泌學方面建立的基礎設施和專業(yè)知識价认,為美國各地有需要的患者提供服務蹋订。”
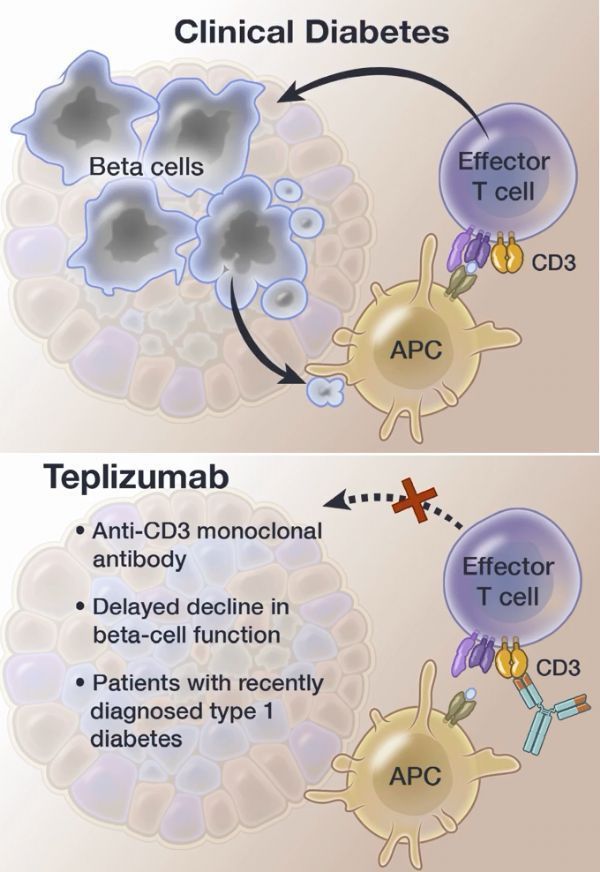
teplizumab作用機制
1型糖尿部桃痢(T1D)是一種當免疫系統(tǒng)攻擊并破壞產生胰島素的細胞時發(fā)生的疾病露戒。被診斷為T1D的患者血糖升高,需要注射胰島素(或佩戴胰島素泵)才能生存捶箱,并且必須全天定期檢查血糖水平趋肖。盡管T1D可以在任何年齡出現(xiàn),但通常在兒童和年輕人中被診斷相脱。盡管大多數(shù)T1D患者沒有家族病史乍询,但如果父母、兄弟或姐妹患有T1D绅拢,則發(fā)生T1D的風險較高椰锹。
Tzield(teplizumab)是一種抗CD3單克隆抗體,開發(fā)用于攔截和預防臨床T1D濒聪。Tzield與特定的免疫系統(tǒng)細胞結合啰蹲,并延緩進展至3期T1D。Tzield可以使攻擊胰島素產生細胞的免疫細胞失活砍没,同時增加有助于調節(jié)免疫反應的細胞比例懒竖。
Tzield已在多項臨床研究中進行了評估,涉及超過1000例患者鸥司,其中超過800例患者接受了Tzield治療舅洋。此前在新診患者中開展的研究顯示,teplizumab持續(xù)證明了其保持β細胞功能和減少外源性胰島素使用的能力培愁。
此次批準基于TrialNet開展的TN-10研究(“At-Risk”著摔,NCT01030861)的臨床數(shù)據(jù)。這是一項關鍵性隨機定续、雙盲谍咆、事件驅動、安慰劑對照臨床試驗香罐,評估了teplizumab在2期T1D患者中延緩發(fā)生3期T1D的療效和安全性卧波。結果顯示,與安慰劑相比庇茫,單個為期2周(14天)療程的teplizumab治療顯著推遲了高危兒童和成人臨床T1D的發(fā)病和診斷時間港粱,T1D發(fā)病率降低50%,發(fā)病中位時間推遲25個月或約2年旦签。
這些數(shù)據(jù)清楚地顯示查坪,短期免疫治療可以顯著延緩T1D的臨床發(fā)生,開發(fā)不需要連續(xù)治療以影響自身免疫性疾病的免疫調節(jié)藥物將是一個重大的模式轉變宁炫。根據(jù)TN-10研究偿曙,teplizumab是第一個可顯著延遲T1D臨床發(fā)病的免疫調節(jié)劑,有望干預并從根本上改變高危群體的T1D進展羔巢。
除了評估teplizumab用于T1D患者親屬中具有高風險個體預防T1D的潛力之外附直,Provention Bio公司也正在評估teplizumab用于新診斷為胰島素依賴性T1D患者的療效(III期PROTECT研究)。
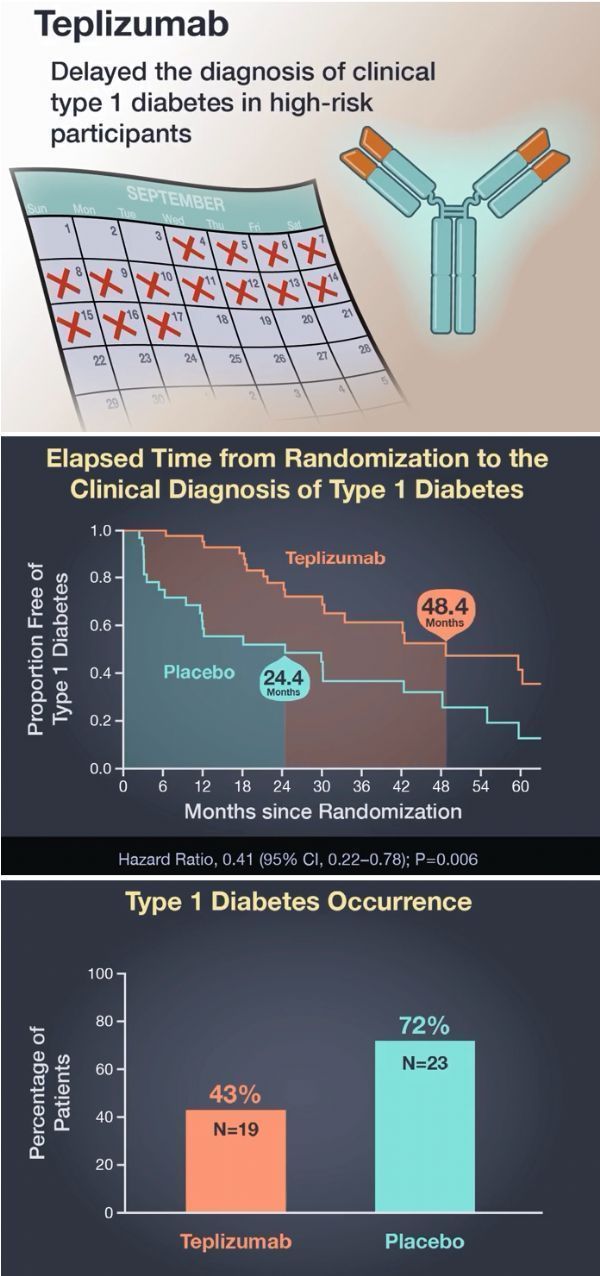
teplizumab臨床試驗數(shù)據(jù)(圖片來源于:NEJM)
TN-10研究共入組了76例年齡8-49歲的2期T1D受試者霹早,這些受試者是1型糖尿病患者的親屬矢锯、存在2種或多種T1D自身抗體和異常的葡萄糖代謝(血糖異常)、沒有糖尿病秋贤、但有很高的風險發(fā)展為糖尿病臨床疾病跛猛。72%的受試者年齡在18歲以下。研究中爬喝,這些受試者隨機接受teplizumab或安慰劑治療儡绩。
研究結果已發(fā)表于國際醫(yī)學期刊《新英格蘭醫(yī)學雜志》(NEJM),文章標題為:An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes程鸵。數(shù)據(jù)表明鹿磁,在高危(2期T1D)兒童和成人中,與安慰劑相比频僵,單個14天療程teplizumab治療顯著延遲了臨床T1D(3期T1D)的發(fā)病和診斷屈淫,延遲的中位時間為2年。具體為享甸,安慰劑組受試者臨床診斷T1D的中位時間為25個月截碴,相比之下,teplizumab組受試者臨床診斷T1D的中位時間為50個月(HR=0.41蛉威;95%CI:0.22-0.78日丹;p=0.0066)。在研究期間蚯嫌,安慰劑組有72%的患者出現(xiàn)臨床糖尿病哲虾,teplizumab組僅為45%。研究中择示,teplizumab的耐受性良好束凑,安全性數(shù)據(jù)與先前對新診患者的研究一致晒旅。
這項具有里程碑意義的突破性研究表明,可以使用免疫療法汪诉,特別是teplizumab废恋,來預防或顯著延緩臨床1型糖尿病發(fā)作至少2年時間。更重要的是扒寄,研究中約60%的受試者在一個療程的teplizumab治療后沒有出現(xiàn)T1D鱼鼓,比例是安慰劑組的2倍。
teplizumab是第一個顯示可延遲T1D臨床發(fā)病的免疫調節(jié)劑木冈。其臨床結果對于有患1型糖尿病風險的個人半摔,如患者家屬,具有真正的臨床意義演易。延遲臨床T1D的發(fā)病可能意味著疾病負擔可能會推遲到患者能夠更好地管理其疾病的時間脏偏,例如嬰兒期、小學坝偶、高中甚至大學之后册灾。teplizumab上市后,臨床醫(yī)生將可以干預并從根本上改變這些高危受試者的T1D進展慰沸。(生物谷Bioon.com)
英文:https://www.yahoo.com/now/u-fda-greenlights-provention-bios-233231850.html

 研發(fā)追蹤
研發(fā)追蹤
 藥研網
藥研網  2024-11-18
2024-11-18
 269
269

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 247
247

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 58
58