
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥觀瀾
醫(yī)藥觀瀾  2022-12-30
2022-12-30
 2965
2965
美國時(shí)間12月22日皿腾,羅氏(Roche)旗下基因泰克(Genentech)宣布为狸,美國FDA已批準(zhǔn)Lunsumio(mosunetuzumab-axgb)用于治療經(jīng)過兩種或多種前期系統(tǒng)治療后復(fù)發(fā)或難治的濾泡性淋巴瘤(FL)成年患者柱涕。根據(jù)基因泰克新聞稿计技,Lunsumio是一款CD20/CD3 T細(xì)胞銜接雙特異性抗體权塑,代表著一種無化療眠寿、現(xiàn)貨型(off-the-shelf)新免疫治療選擇莽鸿。
公開資料顯示,Lunsumio是一款靶向B細(xì)胞表面的CD20抗原和T細(xì)胞表面的CD3受體的T細(xì)胞銜接雙特異性抗體拜轨。它可以引導(dǎo)患者體內(nèi)的T細(xì)胞遷移到目標(biāo)B細(xì)胞附近抽减,并且釋放細(xì)胞毒性的蛋白消滅B細(xì)胞。Lunsumio以靜脈輸注的形式給藥橄碾,持續(xù)時(shí)間固定卵沉,允許休息治療,也可以在門診輸液法牲。此前偎箫,該藥還曾獲FDA授予突破性療法認(rèn)定和孤兒藥資格。今年6月猖沈,該藥在歐盟獲批莱检,用于治療復(fù)發(fā)/難治性濾泡性淋巴瘤成人患者,他們已經(jīng)接受過至少兩種前期系統(tǒng)治療诲狐。
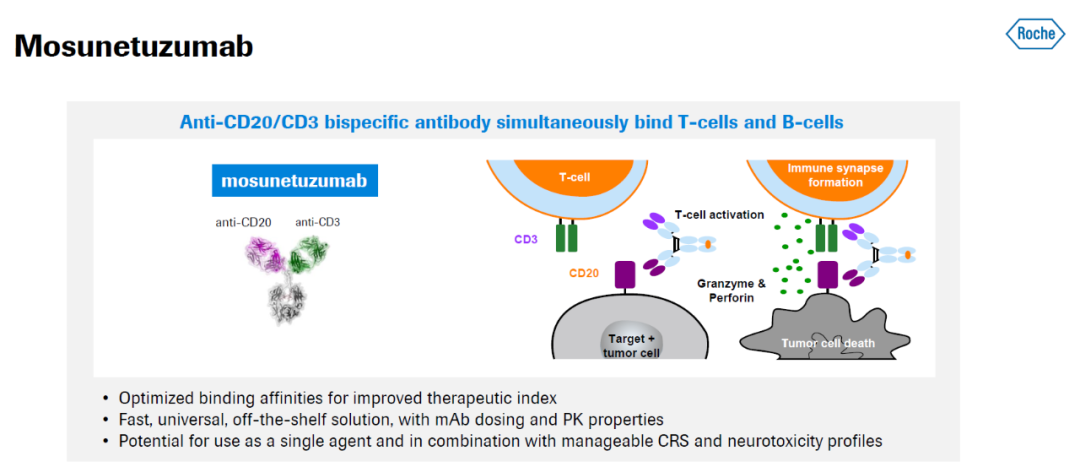
▲Mosunetuzumab的作用機(jī)制(圖片來源:羅氏官網(wǎng))
此次FDA的批準(zhǔn)是基于2期GO29781研究的積極結(jié)果斗赘,該試驗(yàn)結(jié)果顯示出Lunsumio對于復(fù)發(fā)或難治濾泡性淋巴瘤患者具有較高且持久的應(yīng)答率。在接受Lunsumio治療的患者中喧畏,80%的患者出現(xiàn)了客觀反應(yīng)(包括完全反應(yīng)和部分反應(yīng))砍梁,大多數(shù)患者至少18個(gè)月內(nèi)保持了反應(yīng)(57%)。應(yīng)答者的中位應(yīng)答持續(xù)時(shí)間接近2年愤栽。60%的患者獲得完全反應(yīng)(CR)嗤雪。在218名接受推薦劑量Lunsumio治療的血液系統(tǒng)惡性腫瘤患者中,最常見的不良事件(AE)是細(xì)胞因子釋放綜合征(CRS齿喧;39%)妥析,CRS事件的中位持續(xù)時(shí)間為3天。其他常見AE包括疲勞轻欣、皮疹省咨、發(fā)熱和頭痛。
Lunsumio試驗(yàn)研究者Elizabeth Budde博士表示玷室,這一批準(zhǔn)對復(fù)發(fā)或難治性濾泡性淋巴瘤患者來說是一個(gè)重要的里程碑零蓉,他們迄今為止的治療選擇有限。作為一種可在門診環(huán)境中啟動(dòng)的T細(xì)胞結(jié)合雙特異性抗體穷缤,Lunsumio的高應(yīng)答率和固定持續(xù)時(shí)間可能會(huì)改變晚期濾泡性淋巴瘤的治療方式敌蜂。
白血病和淋巴瘤協(xié)會(huì)(LLS)首席科學(xué)官Lee Greenberger博士表示:“對于那些對多種治療方案沒有反應(yīng)的血液癌患者來說箩兽,這一新增的治療方案是一個(gè)好消息,因?yàn)檠┟看螐?fù)發(fā)都會(huì)變得更難治療章喉。這種雙特異性抗體是一種現(xiàn)成的比肄、可獲得的治療選擇,有可能幫助復(fù)發(fā)或難治性濾泡淋巴瘤患者獲得緩解囊陡。”
英文原文:https://www.gene.com/media/press-releases/14978/2022-12-22/fda-approves-genentechs-lunsumio-a-first

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 266
266

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 244
244

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 58
58
 熱門資訊
熱門資訊