
 研發(fā)追蹤
研發(fā)追蹤
 邁極康insight
邁極康insight  2023-01-13
2023-01-13
 3149
3149
1月11日,阿斯利康(AstraZeneca)和Avillion共同宣布虽浆,其聯(lián)合開發(fā)的Airsupra(沙丁胺醇/布地奈德硫薇,PT027)已獲得美國FDA批準宴宠,用于按需治療或預防支氣管收縮,并降低18歲及以上哮喘患者惡化的風險但治。新聞指出碾危,Airsupra(沙丁胺醇/布地奈德,PT027)是首個也是唯一一個在美國批準用于按需治療以降低哮喘惡化風險的急救藥物习诬。
哮喘是一種慢性丛铅、炎癥性呼吸道疾病,癥狀多樣,影響全球多達2.62億人壤趴。哮喘患者會反復出現(xiàn)呼吸困難和喘息涎拉,癥狀會隨時間、嚴重程度和頻率而變化的圆。這些患者無論其疾病嚴重程度鼓拧、是否堅持治療或控制水平如何,都有嚴重惡化的風險越妈。據(jù)估計季俩,全球每年有1.36億例哮喘發(fā)作,其中美國超過1000萬例梅掠;這些對許多患者來說是身體上的威脅和情感上的重大影響酌住,并且可能是致命的。
Airsupra是阿斯利康和Avillion聯(lián)合開發(fā)的一種“first-in-class”的加壓定量吸入器(pMDI)固定劑量組合救援藥物阎抒,含有沙丁胺醇赂韵、一種短效β2激動劑(SABA)和布地奈德,一種抗炎吸入皮質(zhì)類固醇(ICS)挠蛉。
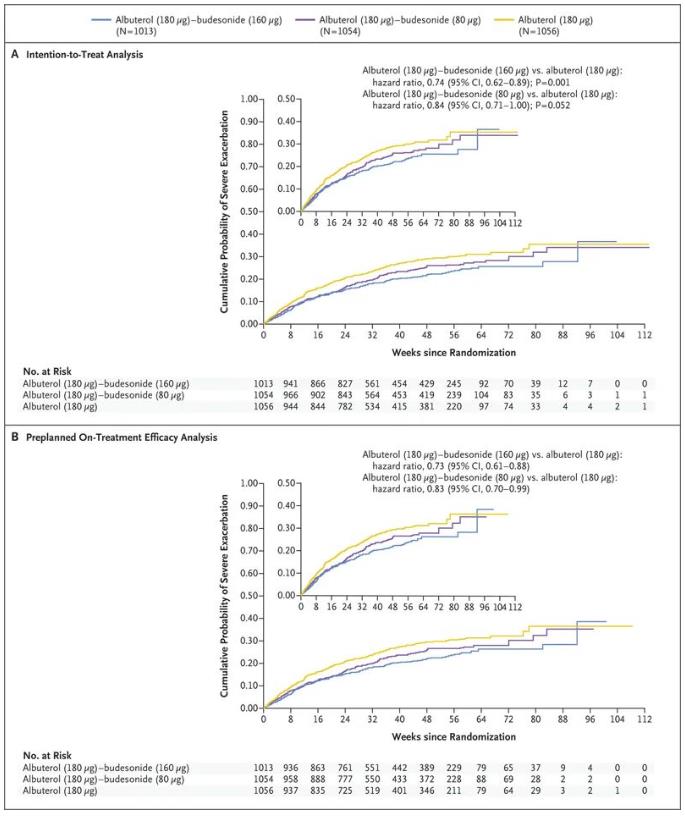
此次FDA的批準是基于MANDALA和DENALI 3期試驗的結(jié)果祭示。MANDALA是一項3期、隨機谴古、雙盲质涛、多中心、平行組少镇、事件驅(qū)動試驗胯炊,旨在評估Airsupra與沙丁胺醇在3132名中度至重度哮喘患者(4-11歲)首次嚴重哮喘加重時間上的療效和安全性,這些哮喘患者單獨服用ICS或聯(lián)合一系列哮喘維持療法效荷。試驗結(jié)果顯示回东,與沙丁胺醇相比,Airsupra在中度至重度哮喘患者中顯著降低了嚴重惡化的風險密士。與沙丁胺醇相比成吓,Airsupra在180mcg沙丁胺醇/160mcg布地奈德劑量下將成人和青少年嚴重惡化的風險降低了27%(p<0.001),嚴重哮喘發(fā)作風險顯著降低26%孙般。MANDALA試驗的相關(guān)結(jié)果已于2022年5月發(fā)表在《新英格蘭醫(yī)學雜志》上切咸。
另一項3期DENALI隨機、雙盲谊蚣、安慰劑對照玲崩、多中心、平行組試驗职鸟,旨在評估Airsupra與其成分沙丁胺醇和布地奈德相比對改善1001名成人盟步、青少年及4-11歲兒童肺功能的療效和安全性藏斩。試驗結(jié)果顯示,與沙丁胺醇和布地奈德的單獨成分或與安慰劑相比却盘,Airsupra在12歲或12歲以上的輕中度哮喘患者中灾茁,通過一秒鐘用力呼氣量(FEV1)測量的肺功能有統(tǒng)計學上的顯著改善。
兩項試驗中Airsupra的安全性和耐受性與已知成分的情況一致谷炸,最常見的不良事件包括頭痛北专、口腔念珠菌病、咳嗽和發(fā)音困難旬陡。
阿斯利康生物制藥研發(fā)執(zhí)行副總裁Mene Pangalos說:“在美國拓颓,每年有超過1000萬的患者經(jīng)歷哮喘加重,而不受控制的哮喘預計將在未來20年給美國經(jīng)濟造成數(shù)十億美元的直接醫(yī)療費用描孟,今天的積極決定對占美國哮喘患者80%以上的成年人哮喘患者來說是個好消息驶睦。醫(yī)生將能夠為他們的患者提供Airsupra,這是一種重要的新型救援療法匿醒,可以降低哮喘惡化的風險场航。”

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 266
266

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 243
243

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 57
57