
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2023-01-13
2023-01-13
 2788
2788
1月10日寇甸,Can-Fite公司宣布已向歐洲藥品管理局(EMA)提交其核心產(chǎn)品piclidenoson(CF101)用于治療中度至重度斑塊狀銀屑病的市場注冊計(jì)劃厌秒。
piclidenoson是Can-Fite開發(fā)的一種新型熏版、首創(chuàng)般婆、可口服的小分子腺苷A3受體(A3R)激動(dòng)劑款熬,通過抑制炎癥細(xì)胞因子白細(xì)胞介素17和23(IL-17和IL-23)的表達(dá)以及誘導(dǎo)致病性皮膚細(xì)胞角化細(xì)胞的凋亡達(dá)到治療效果欧陋。2018年8月唁映,康哲藥業(yè)與Can-Fite達(dá)成協(xié)議,獲得piclidenoson和另一款A(yù)3R激動(dòng)劑namodenoson在中國的開發(fā)挑乓、注冊和商業(yè)化權(quán)益女责。

Can-Fite此次提交市場注冊計(jì)劃的材料主要包括III期COMFORT研究的最終療效和安全性結(jié)果漆枚、即將開展的III期關(guān)鍵試驗(yàn)計(jì)劃以及監(jiān)管機(jī)構(gòu)的注冊建議要求创译。除此之外,Can-Fite還提交了化學(xué)墙基、制造和質(zhì)量控制 (CMC)數(shù)據(jù)软族、非臨床數(shù)據(jù)和人類藥代動(dòng)力學(xué)數(shù)據(jù)。
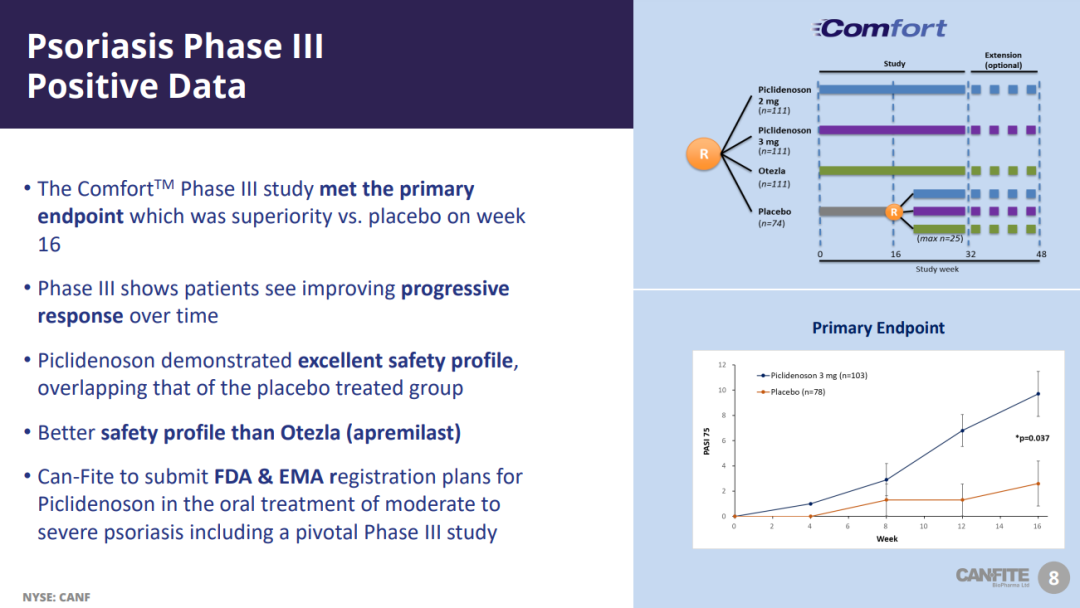
COMFORT研究是一項(xiàng)隨機(jī)残制、雙盲立砸、安慰劑和陽性藥物對(duì)照的臨床試驗(yàn),共納入528例患者初茶,旨在評(píng)估piclidenoson(2mg和3mg)對(duì)比阿普米司特(30mg)和安慰劑治療中度至重度斑塊狀銀屑病患者的療效和安全性颗祝。研究的主要終點(diǎn)為達(dá)到銀屑病面積及嚴(yán)重程度指數(shù)(PASI)評(píng)分改善75%以上(PASI 75)的患者比例(與安慰劑組相比)和不良反應(yīng)概況,關(guān)鍵的次要終點(diǎn)包括銀屑病殘疾指數(shù)(PDI)改善的患者比例(與安慰劑組和阿普米司特組相比)恼布、達(dá)到PASI 75的患者比例(與阿普米司特組相比)和達(dá)到醫(yī)生總體評(píng)估(PGA)評(píng)分0/1的患者比例(與安慰劑組和阿普米司特組相比)等螺戳。
結(jié)果顯示,相比安慰劑組折汞,piclidenoson組患者的皮膚癥狀顯著改善倔幼。具體數(shù)據(jù)為,在第16周整诈,piclidenoson(3mg)組有9.7%的患者達(dá)到了PASI 75坷磷,安慰劑組這一比例為2.6%(P<0.04);在第32周恒晋,piclidenoson(3mg)組有17.0%的患者達(dá)到了PASI 75竹坝,阿普米司特組這一比例為26.2%;在第32周止歇,piclidenoson(3mg)組有20.5%的患者實(shí)現(xiàn)了PDI改善磷兢,阿普米司特組這一比例為10.3%(P<0.05)。此外场暮,在整個(gè)研究期間骏拱,患者對(duì)piclidenoson的反應(yīng)呈線性增強(qiáng),在第48周迁枪,90%的患者達(dá)到了PASI 50难圣,10%的患者達(dá)到了PASI 90缭慈,60%的患者實(shí)現(xiàn)了PDI改善。
安全性方面们豌,與阿普米司特相比涯捻,piclidenoson的安全性更好。具體數(shù)據(jù)為望迎,阿普米司特組有6%的患者發(fā)生胃腸道不良反應(yīng)障癌,而安慰劑組或piclidenoson組這一比例為1%;阿普米司特組有9.9%的患者發(fā)生神經(jīng)系統(tǒng)疾病辩尊,而安慰劑組或piclidenoson組這一比例為0.7%涛浙。
Can-Fite首席執(zhí)行官兼首席戰(zhàn)略官Pnina Fishman博士說:“這一提交代表piclidenoson朝著關(guān)鍵III期研究和隨后的上市批準(zhǔn)邁出了重要的一步。鑒于piclidenoson獨(dú)特的活性和安全性摄欲,我們相信它有可能在260億美元的銀屑病市場占有一席之地轿亮,目前該領(lǐng)域需要安全有效的藥物⌒厍剑”

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 266
266

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 243
243

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 57
57
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽