
 醫(yī)改專題
醫(yī)改專題
 醫(yī)藥云端工作室
醫(yī)藥云端工作室  2023-02-17
2023-02-17
 1445
1445
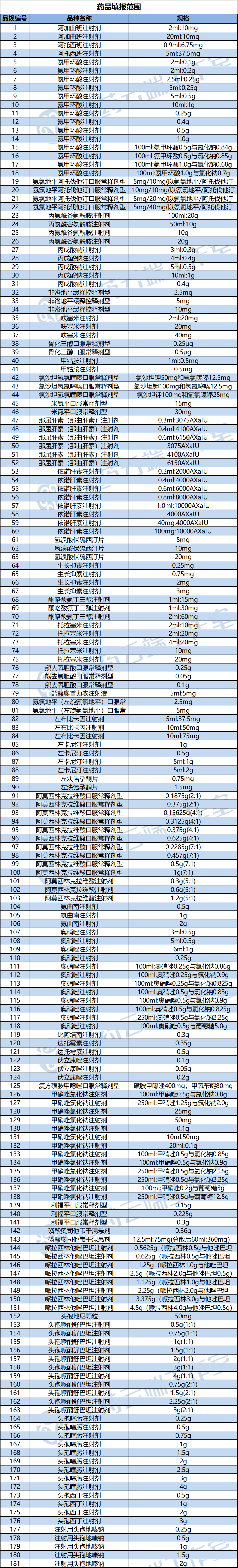
第八批國(guó)采開(kāi)始報(bào)名,涉及41個(gè)品種一共181個(gè)品規(guī)。
此前,我們對(duì)第八批國(guó)采品種進(jìn)行了分析败去,相關(guān)內(nèi)容可查閱文章:
第八批集采進(jìn)入“5家時(shí)代”,41個(gè)品種、181個(gè)品規(guī)疗涎,競(jìng)爭(zhēng)格局匯總(附送Excel表格)
第八批藥品國(guó)采“報(bào)量目錄”來(lái)了?41個(gè)品種罪团、181個(gè)品規(guī)
今日(2月17日)理若,上海陽(yáng)光醫(yī)藥采購(gòu)網(wǎng)發(fā)布《關(guān)于開(kāi)展第八批國(guó)家組織藥品集中采購(gòu)相關(guān)藥品信息填報(bào)工作的通知》:自2023年2月20日起,聯(lián)合采購(gòu)辦公室開(kāi)展第八批國(guó)家組織藥品集中采購(gòu)相關(guān)藥品信息填報(bào)工作嗤渔。
有關(guān)事項(xiàng)通知如下:
一涡似、藥品要求
屬于藥品填報(bào)范圍(詳見(jiàn)文末表格)霸篡、并獲得國(guó)內(nèi)有效注冊(cè)批件、且滿足以下要求之一的上市藥品矫恳,應(yīng)具備相應(yīng)批件或可在國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心《化學(xué)藥品目錄集》中查詢到相應(yīng)結(jié)果:
1咒饼、原研藥及國(guó)家藥品監(jiān)督管理部門發(fā)布的仿制藥質(zhì)量和療效一致性評(píng)價(jià)參比制劑。
2刮赵、通過(guò)國(guó)家藥品監(jiān)督管理部門仿制藥質(zhì)量和療效一致性評(píng)價(jià)的仿制藥品渔硫。
3、根據(jù)《國(guó)家食品藥品監(jiān)督管理總局關(guān)于發(fā)布化學(xué)藥品注冊(cè)分類改革工作方案的公告》〔2016年第51號(hào)〕或《國(guó)家藥監(jiān)局關(guān)于發(fā)布化學(xué)藥品注冊(cè)分類及申報(bào)資料要求的通告》〔2020年第44號(hào)〕编曼,按化學(xué)藥品注冊(cè)分類批準(zhǔn)豆巨,并證明質(zhì)量和療效與參比制劑一致的仿制藥品。
二掐场、企業(yè)要求
屬于本次藥品填報(bào)范圍并滿足藥品要求的相關(guān)企業(yè)往扔,包括:
1、提供藥品及伴隨服務(wù)的國(guó)內(nèi)藥品生產(chǎn)企業(yè)
2熊户、藥品上市許可持有人
3萍膛、境外藥品上市許可持有人境內(nèi)代理人
上述所稱的代理人,是指按照國(guó)家有關(guān)部門關(guān)于境外藥品上市許可持有人境內(nèi)代理人管理規(guī)定嚷堡,取得我國(guó)藥品注冊(cè)證書的境外持有人依法指定蝗罗,代表其履行法律法規(guī)規(guī)定的藥品上市許可持有人義務(wù)的中國(guó)境內(nèi)企業(yè)法人。
三蝌戒、填報(bào)內(nèi)容(略)
四串塑、注意事項(xiàng)(略)

 醫(yī)改專題
醫(yī)改專題
 賽柏藍(lán)器械
賽柏藍(lán)器械  2024-11-22
2024-11-22
 66
66

 醫(yī)改專題
醫(yī)改專題
 中國(guó)醫(yī)療保險(xiǎn)
中國(guó)醫(yī)療保險(xiǎn)  2024-11-22
2024-11-22
 31
31

 醫(yī)改專題
醫(yī)改專題
 中國(guó)醫(yī)療保險(xiǎn)
中國(guó)醫(yī)療保險(xiǎn)  2024-11-21
2024-11-21
 69
69
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽