
 研發(fā)追蹤
研發(fā)追蹤
 邁極康insight
邁極康insight  2023-02-27
2023-02-27
 2338
2338
2月22日称勋,輝瑞宣布FDA已對(duì)Elranatamab的生物制品許可申請(qǐng)(BLA)給予優(yōu)先審查,Elranatamab是一種研究性B細(xì)胞成熟抗原(BCMA)CD3靶向雙特異性抗體盐文,用于復(fù)發(fā)/難治性多發(fā)性骨髓瘤(RRMM)患者材蛛。歐洲藥品管理局(EMA)也接受了Elranatamab在同一適應(yīng)癥中的上市許可申請(qǐng)(MAA)。
Elranatamab的BLA和MAA主要基于來(lái)自MagnetisMM-3(NCT04649359)隊(duì)列A(BCMA-na?ve吐句,n=123)的數(shù)據(jù)的令人鼓舞的結(jié)果孝仅,該試驗(yàn)表明奖肋,使用Elranatamab進(jìn)行中位隨訪10.4個(gè)月的治療導(dǎo)致客觀緩解率(ORR)中央審查(BICR)為61.0%(95%CI仆洞,51.8%-69.6%)的五級(jí)或三級(jí)難治性多發(fā)性骨髓瘤患者众附,并且接受Elranatamab作為他們的第一個(gè)BCMA靶向治療沉南。共有55.3%接受Elranatamab治療的患者有非常好的部分反應(yīng)或更好,27.6%的患者達(dá)到完全緩解或更好刮跟。在達(dá)到完全緩解的患者(n=22)中劣晾,90.9%的患者在10-5的閾值下達(dá)到微小殘留病(MRD)陰性,中位反應(yīng)時(shí)間為1.2個(gè)月唬垦。
盡管未達(dá)到中位無(wú)進(jìn)展生存期(PFS)和總生存期(OS)莫诺,但使用該藥物后6個(gè)月和12個(gè)月的PFS率分別為65.2%和58.8%。此外棱歹,Elranatamab在6個(gè)月時(shí)的OS率為76.1%祠烁,在12個(gè)月時(shí)為63.6%。這些研究結(jié)果表明馁梁,Elranatamab具有可控的安全性,因?yàn)?2/32 mg的2級(jí)啟動(dòng)劑量方案有助于減輕細(xì)胞因子釋放綜合征(CRS)和免疫效應(yīng)細(xì)胞相關(guān)神經(jīng)毒性綜合征(ICANS)的發(fā)生率和嚴(yán)重程度)在隊(duì)列A中接受這種啟動(dòng)方案治療的患者中刃唤「粜模“多發(fā)性骨髓瘤是一項(xiàng)中位生存期約5年的血液腫瘤。作為一款現(xiàn)貨型療法尚胞,靶向BCMA雙特異性抗體將揭開(kāi)新治療選項(xiàng)的序幕硬霍,這將對(duì)此病患者帶來(lái)深遠(yuǎn)的影響,”輝瑞腫瘤學(xué)全球產(chǎn)品開(kāi)發(fā)首席開(kāi)發(fā)官Chris Boshoff博士說(shuō)道笼裳,“由于此藥物的臨床效果與方便的皮下注射特性唯卖,我們相信一旦Elranatamab獲批,將有可能成為治療多發(fā)性骨髓瘤的標(biāo)準(zhǔn)治療躬柬。我們期待與FDA與EMA的合作拜轨,將這項(xiàng)創(chuàng)新療法帶給全球的患者≡是啵”
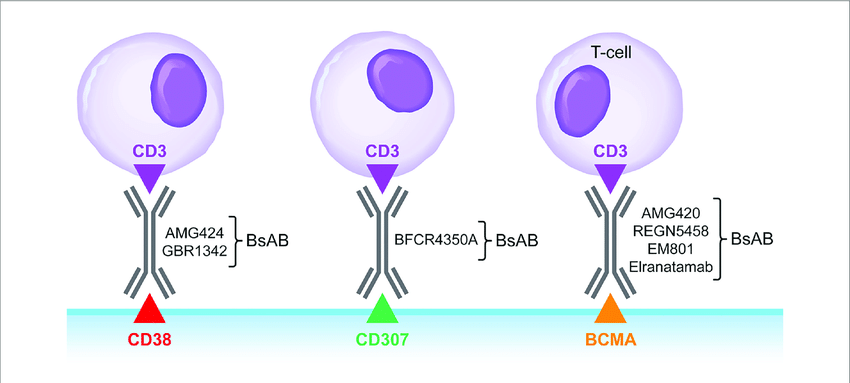
雙特異性抗體是一種新型的腫瘤免疫治療方法橄碾,可以同時(shí)結(jié)合2個(gè)不同的靶點(diǎn),其中一只手臂直接與癌細(xì)胞上的特定抗原結(jié)合颠锉,另一只手臂則激活患者自身免疫系統(tǒng)中的T細(xì)胞并使其更接近癌細(xì)胞將它殺死法牲。Elranatamab旨在結(jié)合多發(fā)性骨髓瘤細(xì)胞表面高度表達(dá)的B細(xì)胞成熟抗原(BCMA)和抗癌T細(xì)胞表面的CD3受體,將它們連接在一起以激活免疫反應(yīng)足贴。Elranatamab對(duì)BCMA和CD3的結(jié)合親和力得到了優(yōu)化牡泡,使T細(xì)胞介導(dǎo)的抗骨髓瘤活性更強(qiáng)。皮下注射elranatamab的目的是允許比靜脈注射更高的劑量哮寨,而不會(huì)增加不良事件尔产。此前,Elranatamab已被美國(guó)食品和藥物管理局(FDA)和歐洲藥品管理局(EMA)授予用于治療多發(fā)性骨髓瘤的孤兒藥指定拟艳。并自FDA獲得快速通道資格與突破性療法認(rèn)定(BTD)喧畏,用于治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤患者砍梁。

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 261
261

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 238
238

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時(shí)間
醫(yī)藥時(shí)間  2024-11-18
2024-11-18
 57
57
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽