
 研發(fā)追蹤
研發(fā)追蹤
 細胞基因治療前沿
細胞基因治療前沿  2023-03-06
2023-03-06
 2657
2657
Intellia Therapeutics周四上午宣布贱案,美國FDA 批準其在美國進行針對遺傳性血管性水腫的體內(nèi)基因編輯療法NTLA-2002的臨床試驗[1]刀脏。
據(jù)悉,Intellia已經(jīng)在新西蘭最住、荷蘭和英國進行早期臨床試驗钞澳,獲得 FDA 批準后,Intellia 將在美國進行第二階段臨床試驗涨缚。
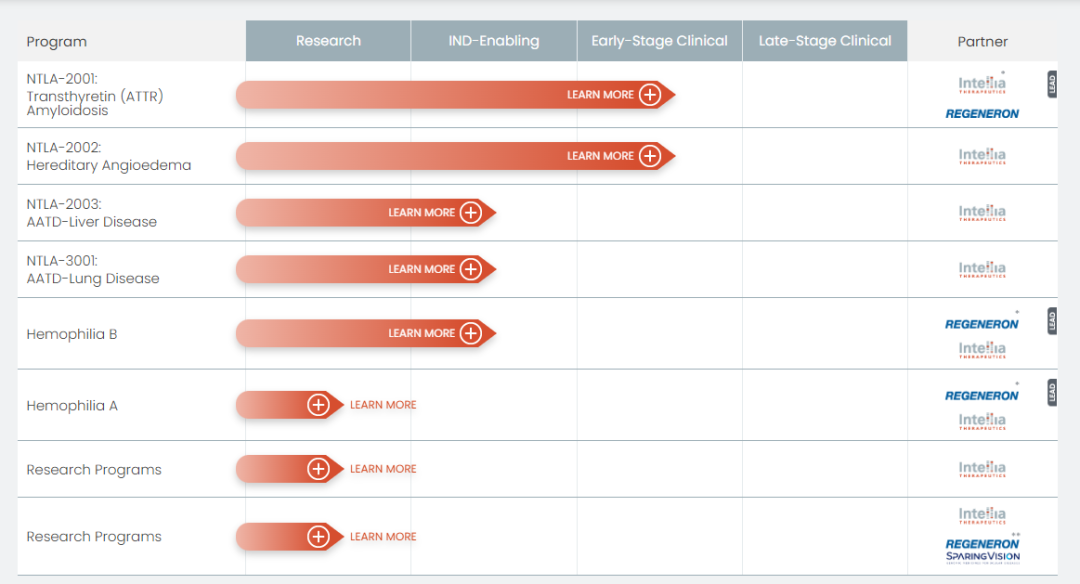
Intellia體內(nèi)編輯療法研發(fā)管線 ?來源:官網(wǎng)
雖然Intellia已經(jīng)在其他國家的人群中測試了其“體內(nèi)”基因編輯療法轧粟,但FDA這次的決定代表首次簽署“體內(nèi)”基因編輯療法人體測試。在此之前脓魏,F(xiàn)DA只允許在人體中進行離體基因編輯療法測試础辉。所以這是Intellia的一個重要里程碑,因為NTLA-2002是FDA批準的第一個用于人體的體內(nèi)基因編輯療法。與此同時知狂,該決定為后續(xù)尋求 FDA 批準的“體內(nèi)”基因療法項目打開了大門[2]搓胯。
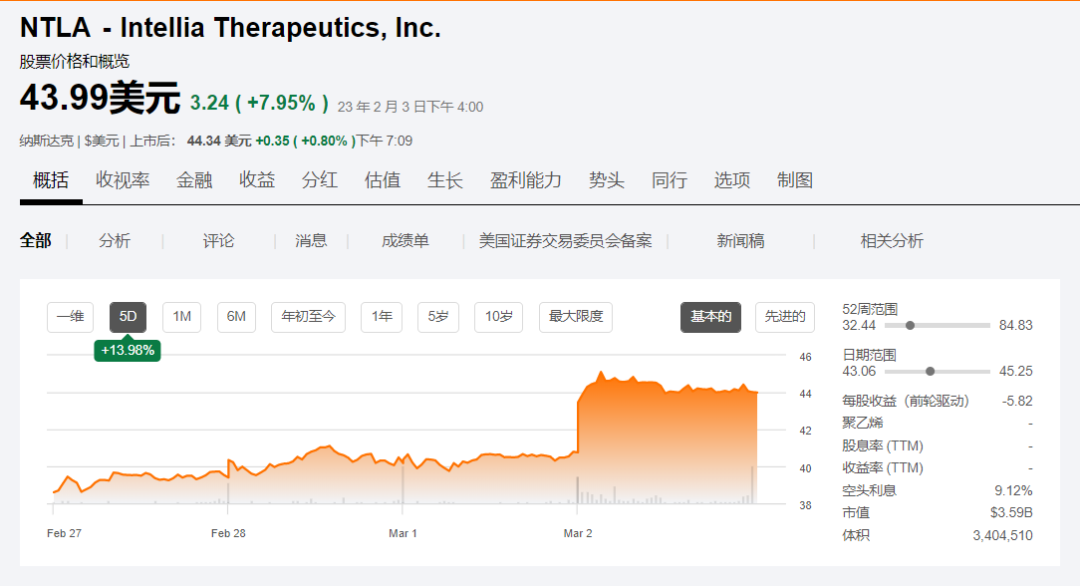
受此影響,Intellia 周四股價上漲 8%啰痒。Intellia 是由 CRISPR 基因編輯技術奠基人臂沽、諾獎得主Jennifer Doudna創(chuàng)立的基因編輯治療公司,目前市值約35.9億美元锥拖。
遺傳性血管性水腫
遺傳性血管性水腫(HAE)是一種罕見遺傳性疾病橡戈,大約50000人中有1人患病,未經(jīng)治療的患者平均7-14 天發(fā)病一次昌漏。按這個比例推算掷雪,我國HAE患者大概在2萬到3萬之間。然而布筷,目前我國已知臨床確診的患者僅500多例肌坑,診斷率不足2.5%[3]。
本病多數(shù)有家族史逢勾,可發(fā)生于任何年齡牡整,通常在30歲前起病,青春期加重溺拱,常伴腹痛、惡心嘔吐谣辞、血清中C1酯酶抑制物(C1-INH)降低等表現(xiàn)[4]迫摔。針對HAE,目前沒有治愈方法泥从,只能進行早篩早診早治句占,緩解相應不適癥狀。
NTLA-2002
Intellia第一款體內(nèi)基因編輯療法是NTLA-2001躯嫉,用于治療轉甲狀腺素蛋白淀粉樣變性纱烘。預計今年年中提交美國申請,并在年底前開始后期研究祈餐。
NTLA-2002作為Intellia第二款體內(nèi)基因編輯療法擂啥,旨在通過 LNP 遞送 CRISPR 基因編輯靶向肝臟細胞的 KLKB1 基因,從而抑制激肽釋放酶的產(chǎn)生萤翔,進而抑制緩激肽的產(chǎn)生俺乓,而緩激肽的過度產(chǎn)生會導致遺傳性血管性水腫的發(fā)作。
Intellia去年披露了NTLA-2002早期研究結果:截至2022年 9月28 日讼谅,三名接受低劑量(25mg)NTLA-2002治療的患者在 5-10 個月內(nèi)沒有發(fā)作檀丝,而且這個時間還在增加。預計 2023 年,Intellia將發(fā)布更多關于NTLA-2002的數(shù)據(jù)残神。

Intellia總裁兼首席執(zhí)行官John Leonard
Intellia總裁兼首席執(zhí)行官John Leonard提到:“Intellia 最初決定在英國開始臨床試驗割懊,因為那里的監(jiān)管機構高度支持基因編輯藥物。所以我們做出判斷新浦,在美國以外的地方進行試驗涤玷,可以讓我們更快獲得臨床數(shù)據(jù)±熳粒”
除了Intellia外称几,其實還有幾家公司布局體內(nèi)基因編輯療法,可惜結果都不理想:要么被暫停稿施,要么停止試驗疫稿,要么未招募患者,具體情況如下:
2022年11月7日鹃两,Verve Therapeutics透露遗座,F(xiàn)DA已暫停了其體內(nèi)堿基編輯療法Verve -101的臨床試驗申請,該療法用于治療雜合子家族性高膽固醇血癥俊扳。這可是世界上首個人體內(nèi)堿基編輯的臨床試驗途蒋,標志著堿基編輯開始進入臨床。
FDA 還批準了少數(shù)用于人體試驗的體內(nèi)基因編輯療法馋记,包括 Editas 和 Excision 用于治療Leber先天性黑蒙10型的體內(nèi)基因編輯療法EDIT-103号坡;Sangamo 用于血友病 B 的體內(nèi)基因編輯方法 SB-FIX; LogicBio 用于甲基丙二酸血癥的體內(nèi)基因編輯療法LB-001梯醒。但是在數(shù)據(jù)顯示藥物無效后宽堆,Editas 正在結束其試驗,而 Sangamo 在僅招募一名患者后于 2021 年終止了研究茸习。LogicBio被阿斯利康收購后畜隶,其試驗目前顯示“未招募”。
其實号胚,美國一直不太接受體內(nèi)基因編輯療法籽慢,一是民眾對該療法的利弊尚不完全清楚,二是具有宗教信仰的民眾認為基因編輯技術是一種對自然的挑戰(zhàn)崎亚。此次Intellia體內(nèi)基因編輯療法在美國獲批臨床試驗湘胚,具有里程碑意義。
出處:https://www.biopharmadive.com/news/intellia-fda-crispr-in-vivo-gene-editing-ind/643999/

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 260
260

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 238
238

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 57
57