
 研發(fā)追蹤
研發(fā)追蹤
 香港濟(jì)民藥業(yè)
香港濟(jì)民藥業(yè)  2023-04-17
2023-04-17
 2163
2163
武田公司于2023年4月11日宣布美國食品藥品監(jiān)督管理局(FDA)已經(jīng)批準(zhǔn)了HyQvia(人正常免疫球蛋白(10%)以搏,重組人透明質(zhì)酸酶)的一項(xiàng)補(bǔ)充生物制劑許可申請(sBLA)笛吱,擴(kuò)大至2至16歲患有原發(fā)性免疫缺陷(PI)的兒童藤韵。HYQVIA最初于2014年獲得批準(zhǔn)献凫,用于治療成人原發(fā)性免疫缺陷钮糖。
此前,HyQvia已于2013年5月獲歐盟批準(zhǔn)茫叭,作為一種替代療法会烙,用于原發(fā)性免疫缺陷綜合征及伴有繼發(fā)性低丙種球蛋白血癥和反復(fù)感染的骨髓瘤或慢性淋巴細(xì)胞白血病成人患者(≥18歲)的治療。
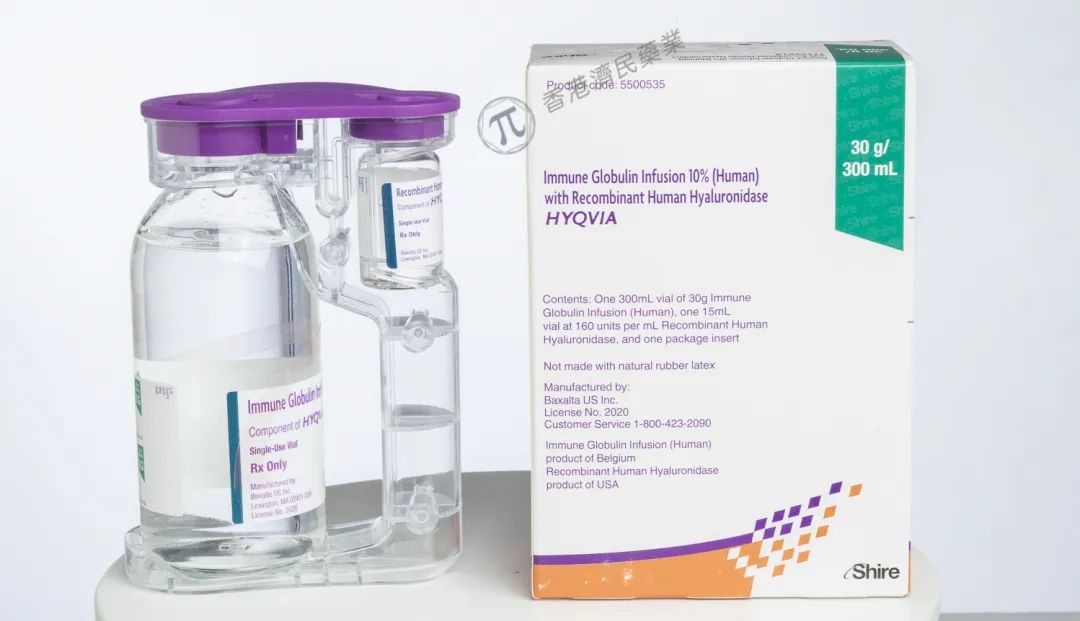
HyQvia由人正常免疫球蛋白(IG韭赘,10%)和重組人透明質(zhì)酸酶(hyaluronidase)組成的皮下免疫球蛋白療法缩滨,透明質(zhì)酸酶有利于IGSC的分散和吸收。HyQvia是獲批用于原發(fā)性免疫缺陷癥治療的首個每月一次的皮下注射免疫球蛋白泉瞻,每月僅需皮下注射一次脉漏,且在單個注射部位即可提供全部的治療劑量。目前袖牙,大多數(shù)PI患者需在醫(yī)院接受靜脈輸液治療侧巨,而在HyQvia之前的皮下注射IG藥物,需要每周或每2周注射一次鞭达,且每次注射時需在多個位點(diǎn)注射司忱。
對于2-16歲的兒科患者而言,HyQvia皮下免疫球蛋白療法可以為醫(yī)療保健提供者和家庭提供了一種作為靜脈注射或更頻繁皮下給藥的替代方案畴蹭,減少患者給藥頻率坦仍。
擴(kuò)大的監(jiān)管批準(zhǔn)是基于在44名年齡在2歲至16歲的原發(fā)性免疫缺陷患者中進(jìn)行的一項(xiàng)非盲、關(guān)鍵叨襟、非對照堆嘿、前瞻性III期臨床試驗(yàn)獲得的數(shù)據(jù)。
研究發(fā)現(xiàn)HyQvia可有效治療急性嚴(yán)重細(xì)菌感染围娃。這是該試驗(yàn)的主要終點(diǎn)技乡。試驗(yàn)持續(xù)了12個月,每名受試者的總感染率進(jìn)一步證明了該藥物的療效碎痘。
在安全性方面技碍,中期數(shù)據(jù)分析的結(jié)果表明安全性特征與成人相似皇苫。不同年齡組之間的免疫球蛋白G(IgG)谷低濃度無臨床意義的差異。

 研發(fā)追蹤
研發(fā)追蹤
 藥研網(wǎng)
藥研網(wǎng)  2024-11-18
2024-11-18
 259
259

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-18
2024-11-18
 237
237

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥時間
醫(yī)藥時間  2024-11-18
2024-11-18
 57
57
 熱門資訊
熱門資訊