
 研發(fā)追蹤
研發(fā)追蹤
 2016-12-13
2016-12-13
 4928
4928
來源:藥明康德??? 2016-12-13
近日,Biogen公司在會議上公布了aducanumab的1b期(PRIME)臨床研究的最新數(shù)據(jù)汤顷,針對早期阿茲海默苍耙(AD)的治療符晃。此次公布的數(shù)據(jù)包括來自1b期研究滴定隊列(安慰劑對照)的中期結(jié)果以及來自長期延長研究(LTE)的第一年數(shù)據(jù)趁俊。該結(jié)果也將支持正在進行的使用aducanumab治療早期AD的3期階段臨床試驗研究橡宪。
AD是一種進行性神經(jīng)退行疾病篮灼,其特征在于認知衰退和行為障礙德频,最終導致不能進行日诚输觯活動源譬。據(jù)2010年數(shù)據(jù)統(tǒng)計集惋,全世界約有2500萬AD患者。多年醫(yī)學研究表明該疾病在臨床診斷的癥狀出現(xiàn)多年之前踩娘,相關(guān)病生理變化就已經(jīng)存在了刮刑。隨著AD疾病的進展,相關(guān)的認知障礙养渴、行為變化和功能障礙開始逐步顯現(xiàn)张重。AD患者大腦內(nèi)β淀粉樣蛋白的非正常堆積會影響神經(jīng)元的正常功能,并導致神經(jīng)細胞的凋亡伍茎。因此斥稍,如何將這種沉積蛋白清除出大腦便成為了目前AD研究的重點之一,有望成為治療的突破口已清。
Aducanumab(BIIB037)是Biogen正在開發(fā)用于治療早期AD的在研新藥态晤,它是利用Neurimmune公司的RTM(Reverse Translational Medicine,反向轉(zhuǎn)化醫(yī)學)技術(shù)平臺而獲得的卷霜。研究人員對比了來自無認知障礙健康老年受試者和具有異常緩慢認知衰退的障礙性老年受試者的B細胞文庫喧盲,然后獲得了aducanumab人源重組單克隆抗體。該創(chuàng)新型藥物可靶向聚集形式存在的β淀粉樣蛋白遗渊,選擇性地和腦內(nèi)的淀粉樣斑塊結(jié)合鄙幸,然后通過激活免疫系統(tǒng),將沉積蛋白清理出大腦什异。2016年9月邦墅,美國FDA授予了aducanumab快速通道資格。
該1b期研究是一項隨機津函、雙盲肖粮、安慰劑對照的多劑量研究,在197名輕度AD患者中評估了aducanumab的安全性尔苦、耐受性涩馆、藥代動力學(PK)、藥效動力學(PD)和臨床效果允坚。
1b期研究包括了體重每公斤1毫克(n=31)魂那、3毫克(n=33)、6毫克(n=30)和10毫克(n=32)的固定劑量組稠项;滴定方案組(n=23)和合并的安慰劑組(n=48)涯雅。該研究還包括了完成研究一年后安慰劑對照部分患者的長期延長研究(LTE)。在CTAD會議上公布的aducanumab相關(guān)數(shù)據(jù)與先前該研究的結(jié)果分析一致展运。在54周時活逆,相對于安慰劑組,所有固定劑量組中觀察到了淀粉樣蛋白斑塊統(tǒng)計學上的顯著減少:1mg/kg[-0.050(p<0.05)]拗胜、3mg/kg [-0.130(p<0.001)]蔗候、6mg/kg [-0.206(p <0.001)]怒允、10mg/kg [-0.263(p <0.001)]和滴定組[-0.171(p<0.001)]。
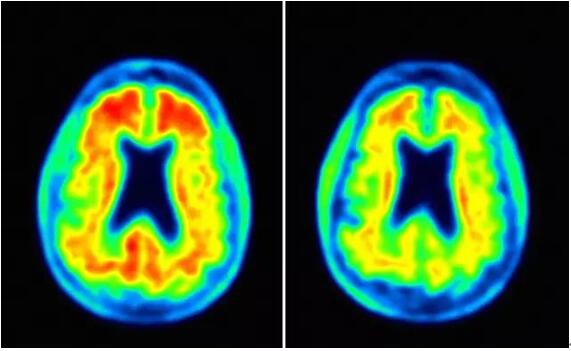
▲Aducanumab治療(右)可減少淀粉樣蛋白斑塊(圖片來源:Fortune )
同時矫撤,LTE研究前12個月的探索性終點分析也表明思袋,用aducanumab治療長達24個月后,患者繼續(xù)在淀粉樣蛋白斑的減少量方面具備功效赃勺。
Aducanumab目前正在兩個全球性3期臨床試驗ENGAGE和EMERGE中被評估估骡,旨在研究其在早期阿茲海默病患者中減緩認知障礙和殘疾進展的安全性和有效性。
“在CTAD會議上更新的數(shù)據(jù)支持了aducanumab的1b期研究中先前看到的陽性良好結(jié)果筝妥,并且我們在治療達兩年患者中觀察到了效應暮霍,”Biogen的臨床開發(fā)副總裁Samantha Budd Haeberlein博士說道:“我們致力于推進全球范圍的aducanumab 3期臨床項目,同時增加對阿茲海默病的了解屋问,發(fā)掘更多創(chuàng)新治療方法驳墓。”

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 92
92

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 93
93

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 92
92