
 醫(yī)改專題
醫(yī)改專題
 識(shí)林
識(shí)林  2023-09-19
2023-09-19
 1633
1633
【創(chuàng)新與臨床研究】
9.12匙典,【CDE】關(guān)于公開征求《間充質(zhì)干細(xì)胞防治移植物抗宿主病臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知
9.12玻孟,【CDE】關(guān)于公開征求《罕見病基因治療產(chǎn)品臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知
9.12揍久,【科技部】關(guān)于發(fā)布人類遺傳資源管理常見問題解答的通知
【CMC與仿制藥】
9.14理斜,【藥典會(huì)】新增大量常用通則標(biāo)準(zhǔn)草案的公示峭签,包括HPLC晶乘,熾灼殘?jiān)烈#b量,崩解翠笛,溶出等
【注冊(cè)與審評(píng)】
9.11由饵,【NMPA】關(guān)于調(diào)整麻醉藥品和精神藥品目錄的公告(2023年第120號(hào))
【GMP與生產(chǎn)】
9.7,【中國(guó)醫(yī)藥設(shè)備工程協(xié)會(huì)】《無(wú)菌藥品生產(chǎn)污染控制策略技術(shù)指南 (征求意見稿)》發(fā)布桦徘,公開征求意見
9.12故咽,【福建省】關(guān)于印發(fā)《福建省藥品生產(chǎn)日常監(jiān)督管理辦法》的通知
9.12,【福建省】關(guān)于印發(fā)《福建省藥品生產(chǎn)質(zhì)量管理規(guī)范符合性檢查工作程序》的通知
【政策法規(guī)綜合】
9.6橄文,【NMPA】新增18篇對(duì)全國(guó)人大代表和政協(xié)委員建議提案回復(fù)化刻,包括兒童藥,境外轉(zhuǎn)境內(nèi)上陕,改良新等等業(yè)界重點(diǎn)議題
【新藥批準(zhǔn)和報(bào)產(chǎn)】
9.11-9.17桩砰,NMPA發(fā)布4個(gè)新藥批準(zhǔn),CDE受理7個(gè)NDA
【創(chuàng)新與臨床研究】
9.12释簿,【CDE】關(guān)于公開征求《間充質(zhì)干細(xì)胞防治移植物抗宿主病臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知
移植物抗宿主惭怯纭(graft-versus-host disease, GvHD)是異基因造血干細(xì)胞移植術(shù)后并發(fā)癥和非復(fù)發(fā)性死亡的主要原因,防治 GvHD 對(duì)保證移植成功及移植后長(zhǎng)期生存有重要意義辕万。間充質(zhì)干細(xì)胞治療 GvHD 的臨床試驗(yàn)進(jìn)展較為迅速枢步。目前國(guó)內(nèi)外無(wú)相關(guān)的臨床試驗(yàn)技術(shù)指導(dǎo)原則,為提供關(guān)于間充質(zhì)干細(xì)胞防治移植物抗宿主病臨床試驗(yàn)的建議渐尿,提高相關(guān)產(chǎn)品的研究和申報(bào)效率醉途,盡快滿足患者的臨床需求,CDE生物制品臨床部起草了本指導(dǎo)原則砖茸。本指導(dǎo)原則并非直接借鑒國(guó)外已發(fā)布的指導(dǎo)原則隘擎,主要圍繞臨床試驗(yàn)的考慮及建議進(jìn)行闡述,申辦者可以依據(jù)研發(fā)目的在開展間充質(zhì)干細(xì)胞防治移植物抗宿主病臨床試驗(yàn)時(shí)參考凉夯。
9.12货葬,【CDE】關(guān)于公開征求《罕見病基因治療產(chǎn)品臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》意見的通知
CDE的起草思路,首先在概述部分介紹撰寫背景和目的咳衣,然后闡述針對(duì)罕見病的疾病自然史和生物標(biāo)志物的一般考慮共撰,臨床試驗(yàn)設(shè)計(jì)要點(diǎn)部分,對(duì)罕見病基因治療產(chǎn)品開展臨床試驗(yàn)的受試人群故碱、受試者鞋夹、研究設(shè)計(jì)、給藥方案炎殃、有效性評(píng)價(jià)孕炒、安全性評(píng)價(jià)統(tǒng)計(jì)假設(shè)、免疫原性研究、藥代動(dòng)力學(xué)研究仪但、藥效學(xué)研究潦博、合并用藥等方面進(jìn)行指導(dǎo)。最后從基因治療產(chǎn)品開展罕見病臨床試驗(yàn)總體考慮呀净、特殊人群的考慮竖怯、臨床試驗(yàn)設(shè)計(jì)角度考慮對(duì)風(fēng)險(xiǎn)管理提出建議。本指導(dǎo)原則將結(jié)合罕見病特征杨匕、基因治療產(chǎn)品特征着饥,對(duì)罕見病基因治療產(chǎn)品的臨床研發(fā)提出建議犀农,為罕見病基因治療產(chǎn)品開展臨床試驗(yàn)提供參考惰赋。
9.12,【科技部】關(guān)于發(fā)布人類遺傳資源管理常見問題解答的通知
科技部行政審批受理窗口針對(duì)《人類遺傳資源管理?xiàng)l例實(shí)施細(xì)則》(以下簡(jiǎn)稱“《實(shí)施細(xì)則》”)發(fā)布以來(lái)申請(qǐng)人在辦理人類遺傳資源行政審批和備案等事項(xiàng)時(shí)咨詢的常見問題呵哨,凝練形成了《人類遺傳資源管理常見問題解答》赁濒,供申請(qǐng)人在申報(bào)過程中進(jìn)行參考。需注意孟害,往期發(fā)布的常見問題(由“版本歷史”可知拒炎,分別發(fā)布于2022年3月和4月)解答同時(shí)作廢。共計(jì)四個(gè)部分挨务,30個(gè)問題:一击你、采集、保藏行政許可二谎柄、國(guó)際合作行政許可與備案三丁侄、信息對(duì)外提供或開放使用事先報(bào)告四、其他問題
【CMC與仿制藥】
9.14朝巫,【藥典會(huì)】新增大量常用通則標(biāo)準(zhǔn)草案的公示鸿摇,包括HPLC,熾灼殘?jiān)梢啵b量皮卸,崩解,溶出等
國(guó)家藥品標(biāo)準(zhǔn)提高課題擬立項(xiàng)目錄公示(2023年度第二批)關(guān)于藥品包裝用塑料容器及組件相關(guān)11個(gè)通則標(biāo)準(zhǔn)草案的公示關(guān)于苯甲酸芐酯藥用輔料標(biāo)準(zhǔn)草案的公示關(guān)于0512 高效液相色譜法標(biāo)準(zhǔn)草案的公示關(guān)于0542 毛細(xì)管電泳法標(biāo)準(zhǔn)草案的公示關(guān)于0923 片劑脆碎度檢查法標(biāo)準(zhǔn)草案的公示關(guān)于0931 溶出度與釋放度測(cè)定法標(biāo)準(zhǔn)草案的公示關(guān)于0940 單位劑量均勻性檢查法標(biāo)準(zhǔn)草案的公示關(guān)于0921 崩解時(shí)限檢查法標(biāo)準(zhǔn)草案的公示關(guān)于0942 最低裝量檢查法標(biāo)準(zhǔn)草案的公示關(guān)于0841 熾灼殘?jiān)鼨z查法標(biāo)準(zhǔn)草案的公示關(guān)于不確定度評(píng)定指導(dǎo)原則標(biāo)準(zhǔn)草案的公示關(guān)于分析儀器確證指導(dǎo)原則標(biāo)準(zhǔn)草案的公示關(guān)于0400光學(xué)分析法標(biāo)準(zhǔn)草案的公示關(guān)于掃描電子顯微鏡法標(biāo)準(zhǔn)草案的公示
【注冊(cè)與審評(píng)】
9.11离饺,【NMPA】關(guān)于調(diào)整麻醉藥品和精神藥品目錄的公告(2023年第120號(hào))
根據(jù)《麻醉藥品和精神藥品管理?xiàng)l例》有關(guān)規(guī)定猿池,國(guó)家藥品監(jiān)督管理局、公安部疼尺、國(guó)家衛(wèi)生健康委員會(huì)決定調(diào)整麻醉藥品和精神藥品目錄》6辏現(xiàn)公告如下:一、 將泰吉利定列入麻醉藥品目錄功刽。二害恋、 將地達(dá)西尼、依托咪酯(在中國(guó)境內(nèi)批準(zhǔn)上市的含依托咪酯的藥品制劑除外)列入第二類精神藥品目錄。三赎丢、 將莫達(dá)非尼由第一類精神藥品調(diào)整為第二類精神藥品劣零。本公告自2023年10月1日起施行。
【GMP與生產(chǎn)】
9.7福压,【中國(guó)醫(yī)藥設(shè)備工程協(xié)會(huì)】《無(wú)菌藥品生產(chǎn)污染控制策略技術(shù)指南 (征求意見稿)》發(fā)布掏秩,公開征求意見
團(tuán)體標(biāo)準(zhǔn)是官方法規(guī)指南的有效補(bǔ)充,識(shí)林的“行業(yè)協(xié)會(huì)”頁(yè)面專門收錄重要協(xié)會(huì)的實(shí)用團(tuán)體標(biāo)準(zhǔn)荆姆。此次中國(guó)醫(yī)藥設(shè)備工程協(xié)會(huì)發(fā)布意見稿指導(dǎo)企業(yè)實(shí)踐CCS蒙幻,正是行業(yè)熱點(diǎn)和難點(diǎn)。針對(duì)目前企業(yè)在制定污染控制策略時(shí)所存在的各控制和監(jiān)測(cè)措施如何有機(jī)結(jié)合胆筒、現(xiàn)有控制和監(jiān)測(cè)方式的有效性如何評(píng)估邮破、污染控制策略如何與現(xiàn)有質(zhì)量體系協(xié)同作用等難點(diǎn),本指南仆救,旨在為業(yè)界提供藥品生產(chǎn)過程中污染控制策略的設(shè)計(jì)抒和、實(shí)施、評(píng)估和管理的相關(guān)指導(dǎo)彤蔽,幫助業(yè)界企事業(yè)單位和人員理解污染控制策略的理念摧莽,更加有效地建立和實(shí)施污染控制策略。本指南為藥品生產(chǎn)企業(yè)顿痪、廠房設(shè)施設(shè)計(jì)單位镊辕、設(shè)備制造商等提供技術(shù)參考,不具有強(qiáng)制性蚁袭。本指南適用于無(wú)菌藥品的微生物掸柏、熱原/內(nèi)毒素和微粒的污染控制實(shí)踐,不涉及交叉污染的相關(guān)要求乌换。非無(wú)菌藥品不在本指南的討論范圍內(nèi)稿棚,但對(duì)其進(jìn)行污染控制改進(jìn)時(shí)可作參考。
9.12取阳,【福建省】關(guān)于印發(fā)《福建省藥品生產(chǎn)日常監(jiān)督管理辦法》的通知
本辦法所稱藥品生產(chǎn)日常監(jiān)督管理采缎,是指藥品監(jiān)督管理部門對(duì)藥品生產(chǎn)單位的生產(chǎn)(含配制,下同)條件灌罐、生產(chǎn)過程和質(zhì)量管理等敌菩,依法履行監(jiān)管職責(zé)所進(jìn)行的監(jiān)督檢查、抽檢坡循、監(jiān)測(cè)疏拱、行政處罰等監(jiān)督管理活動(dòng)。文中肯拨,福建省局在多個(gè)企業(yè)關(guān)注熱點(diǎn)上給出相當(dāng)明確的監(jiān)管措施榕每,站在企業(yè)角度,也未嘗不是一種支持。
規(guī)定可以委托檢驗(yàn)的情形有哪些栏尚?報(bào)告的時(shí)限和要求起愈?
對(duì)質(zhì)量受權(quán)人(質(zhì)量管理負(fù)責(zé)人)管理提出了哪些要求?
規(guī)定停產(chǎn)報(bào)告的情形有哪些译仗?報(bào)告的時(shí)限和要求抬虽?
規(guī)定倉(cāng)儲(chǔ)、公用系統(tǒng)纵菌、質(zhì)量控制實(shí)驗(yàn)室變更報(bào)告的情形有哪些阐污?報(bào)告的時(shí)限和要求?
藥品監(jiān)督管理部門根據(jù)監(jiān)督檢查情況綜合判定的檢查結(jié)論有哪些咱圆,針對(duì)不同檢查結(jié)論分別采取哪些措施笛辟?
9.12,【福建省】關(guān)于印發(fā)《福建省藥品生產(chǎn)質(zhì)量管理規(guī)范符合性檢查工作程序》的通知
《工作程序》共5章34條闷堡。主要內(nèi)容包括:一是明確定義和適用范圍隘膘。明確GMP符合性檢查及其各個(gè)分類的定義疑故,列出各類別的申請(qǐng)情形杠览,適用于福建省內(nèi)GMP符合性檢查的申請(qǐng)/發(fā)起、檢查和結(jié)果處理昵乾。二是厘清部門職能分工牺缰。對(duì)省局藥品生產(chǎn)處、稽查辦及省核查中心的職能進(jìn)行梳理歼取,要求在各自職責(zé)范圍內(nèi)承擔(dān)相關(guān)工作醋咒。省核查中心負(fù)責(zé)《工作程序》中各種GMP符合性檢查的具體實(shí)施。三是規(guī)范檢查工作程序踱措。明確各類別檢查的情形晦苞、檢查程序、檢查方式毕嘹、檢查時(shí)限浊娄、結(jié)果認(rèn)定、缺陷整改要求及結(jié)果公開方式等相關(guān)內(nèi)容沸幅。四是指出簡(jiǎn)化程序情形矗夯。明確豁免、優(yōu)先及優(yōu)化檢查的情形聪弊,并建立溝通交流機(jī)制施翰,對(duì)申請(qǐng)人無(wú)法確定是否要申請(qǐng)藥品GMP符合性檢查的,可向省局申請(qǐng)溝通交流购城。
【政策法規(guī)綜合】
9.6吕座,【NMPA】新增18篇對(duì)全國(guó)人大代表和政協(xié)委員建議提案回復(fù),包括兒童藥,境外轉(zhuǎn)境內(nèi)吴趴,改良新等等業(yè)界重點(diǎn)議題
在學(xué)習(xí)運(yùn)用法規(guī)指南之余菱蔬,NMPA發(fā)布的提案回復(fù)函也頗有價(jià)值,不僅可以看出當(dāng)今業(yè)界最為關(guān)心的訴求史侣,也能從藥監(jiān)部門(以及會(huì)同回復(fù)的部委)的政策導(dǎo)向拴泌。識(shí)林專門建立“政策法規(guī)?> 國(guó)內(nèi)藥監(jiān)?> 法規(guī)文件?> 工作文件”,收集此類函件惊橱,供用戶參考蚪腐。此次更新總計(jì)18篇,涉及議題如下:張懿宸委員:《關(guān)于推動(dòng)兒童藥高質(zhì)量發(fā)展的提案》歐陽(yáng)華代表:關(guān)于進(jìn)一步優(yōu)化境外生產(chǎn)藥品轉(zhuǎn)移至境內(nèi)生產(chǎn)的政策規(guī)章税朴、推動(dòng)生物醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展的建議杜振興等代表:關(guān)于將特醫(yī)食品統(tǒng)一收費(fèi)編碼和加強(qiáng)特醫(yī)食品監(jiān)管回季,推進(jìn)特醫(yī)食品臨床應(yīng)用的建議李玉梅代表:鼓勵(lì)改良型新藥創(chuàng)新發(fā)展的建議李思進(jìn)委員:《關(guān)于加快臨床價(jià)值明確藥品參比制劑發(fā)布的提案》謝紅委員:《關(guān)于加快對(duì)臨床價(jià)值明確、無(wú)參比制劑類兒童用藥產(chǎn)品審評(píng)審批的提案》藍(lán)景芬代表:關(guān)于創(chuàng)新發(fā)展傳統(tǒng)民族醫(yī)藥大力推動(dòng)浙西南畬醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展的建議杜薇代表“關(guān)于推動(dòng)貴州民族醫(yī)藥列入中華人民共和國(guó)藥典的建議”徐蘭賓代表:“關(guān)于推進(jìn)國(guó)家區(qū)域醫(yī)療中心院內(nèi)特色制劑跨省流通的建議”韓琳代表:關(guān)于完善中藥配方顆粒相關(guān)政策的建議鄭喆軒代表:關(guān)于科學(xué)制訂和規(guī)范執(zhí)行中藥配方顆粒相關(guān)政策正林,促進(jìn)中藥產(chǎn)業(yè)健康持續(xù)發(fā)展的建議孫達(dá)委員:《關(guān)于加快推進(jìn)中藥配方顆粒國(guó)標(biāo)制定泡一,規(guī)范中藥配方顆粒備案機(jī)制的提案》姚卓勻代表:關(guān)于加快建設(shè)視障人士安全用藥無(wú)障礙環(huán)境的建議陳瑋代表:關(guān)于推動(dòng)國(guó)產(chǎn)HPV疫苗加速上市的建議張海軍代表:關(guān)于引導(dǎo)生物醫(yī)藥醫(yī)療器械產(chǎn)業(yè)走出國(guó)門參與國(guó)際循環(huán)的建議袁玉宇代表:關(guān)于允許高性能醫(yī)療器械研發(fā)真實(shí)性核查前置的建議馬一德代表:關(guān)于以RCEP實(shí)施為契機(jī),推動(dòng)我國(guó)創(chuàng)新藥走出去的建議馬永平代表:關(guān)于提升公眾醫(yī)藥知識(shí)水平桃铛,加強(qiáng)人民維護(hù)健康能力的建議
【新藥批準(zhǔn)和報(bào)產(chǎn)】
9.11-9.17肋森,NMPA發(fā)布4個(gè)新藥批準(zhǔn),CDE受理7個(gè)NDA
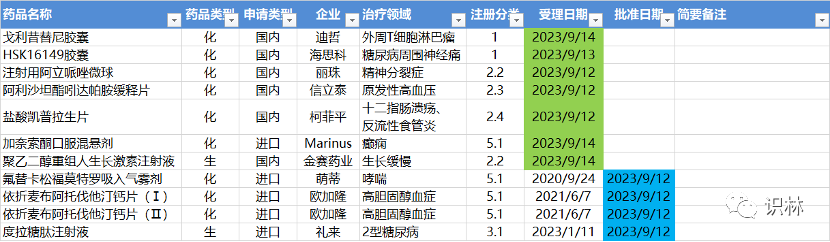
注:僅列出新藥(包括改良型新藥和生物類似藥)的上市申請(qǐng)和批準(zhǔn)上市信息假磺。在“以臨床價(jià)值為導(dǎo)向”的背景下烈杠,申請(qǐng)上市以及獲批的品種,其適應(yīng)癥努扶、臨床研究策略跃百、注冊(cè)路徑,都值得業(yè)界關(guān)注和分析晦了。

 醫(yī)改專題
醫(yī)改專題
 賽柏藍(lán)器械
賽柏藍(lán)器械  2024-11-22
2024-11-22
 53
53

 醫(yī)改專題
醫(yī)改專題
 中國(guó)醫(yī)療保險(xiǎn)
中國(guó)醫(yī)療保險(xiǎn)  2024-11-22
2024-11-22
 25
25

 醫(yī)改專題
醫(yī)改專題
 中國(guó)醫(yī)療保險(xiǎn)
中國(guó)醫(yī)療保險(xiǎn)  2024-11-21
2024-11-21
 61
61
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽