
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2023-11-06
2023-11-06
 1816
1816
X4 Pharmaceuticals宣布,美國FDA已正式接受他們?yōu)?2歲及以上WHIM綜合癥患者遞交的每日一次口服mavorixafor的新藥申請(NDA)别瞭。FDA并授予mavorixafor申請優(yōu)先審評資格懂算,并設定處方藥用戶費用法案(PDUFA)日期為2024年4月30日只冻。根據新聞稿,若獲批计技,mavorixafor將有可能成為WHIM綜合征患者的首個療法喜德。
Mavorixafor是一種在研創(chuàng)新的小分子拮抗劑,靶向CXCR4受體综非。它是專為WHIM綜合癥和某些類型的慢性中性粒細胞減少癥制定的每日一次口服療法沪择。Mavorixafor在獲得FDA授予突破性療法認定、快速通道資格琴偿、孤兒藥資格以及罕見兒科疾病認定(RPD)羞烘。
此NDA的遞交得到了4WHIM全球3期關鍵臨床試驗的支持。這項試驗評估每日一次口服mavorixafor在WHIM綜合癥患者中的療效和安全性划葫。結果令人鼓舞蝉陕,4WHIM試驗達主要終點與關鍵次要終點,即藥物組患者體內中性粒細胞與淋巴細胞的絕對數(shù)量維持在具臨床意義閾值之上的時間彬率,明顯優(yōu)于安慰劑組患者(p<0.0001)托足。
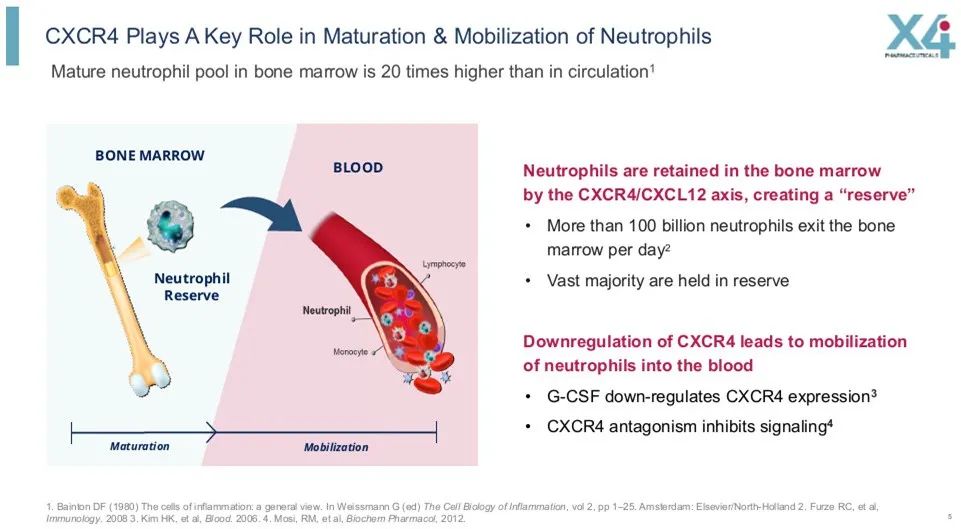
▲CXCR4拮抗劑藥理機制(圖片來源:參考資料[2])
此外,藥物在試驗中顯示了可靠的安全性署隔,沒有報告與治療相關的嚴重不良事件或因安全問題而中斷。重要的是瓦统,試驗數(shù)據還顯示贿妹,與安慰劑相比,接受mavorixafor治療患者感染的頻率金矛、嚴重性和持續(xù)時間均有所減少芯急。
參考資料:
[1] X4 Pharmaceuticals Announces FDA Acceptance withPriority Review of U.S. NDA for Mavorixafor in WHIM Syndrome. Retrieved October31, 2023 from https://investors.x4pharma.com/news-releases/news-release-details/x4-pharmaceuticals-announces-fda-acceptance-priority-review-us
[2] Current Corporate Presentation. Retrieved October 31, 2023from https://investors.x4pharma.com/static-files/eae36b57-f69f-4fba-ad24-eb1012be88b2

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125