
 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2023-11-27
2023-11-27
 2205
2205
1 全球首次獲批
2023年11月17日把意,美國FDA批準由阿斯利康(AstraZeneca)開發(fā)的“first-in-class”新藥AKT抑制劑Truqap(Capivasertib)上市,與Fulvestrant(氟維司群)聯(lián)合使用搓纠,治療激素受體(HR)陽性、人表皮生長因子受體2(HER2)陰性的晚期或轉移性乳腺癌成年患者(至少攜帶一種PIK3CA祷鼎、AKT1或PTEN基因突變)世雄。
此前在2023年6月12日,F(xiàn)DA已授予Capivasertib+氟維司群的新藥申請(NDA)優(yōu)先審評資格映僚,不到半年的時間快速獲批寞竭。
Capivasertib的關鍵CAPItello-291臨床試驗研究結果此前發(fā)表于《新英格蘭醫(yī)學雜志》(NEJM)。它是一項隨機酣难、雙盲谍夭、安慰劑對照III期臨床試驗(NCT04305496),旨在評估Capivasertib+氟維司群用于HR+/HER2-晚期乳腺癌的療效與安全性憨募。該研究共招募708例絕經前/絕經后女性及男性HR+/HER2-晚期乳腺癌患者1:1隨機分為Capivasertib+氟維司群組和安慰劑+氟維司群組紧索,其中共289例(40.8%)患者為AKT通路異常,并且489例(69.1%)患者既往在晚期階段接受過CDK4/6抑制劑治療馋嗜。本研究以總人群和伴有AKT通路異常(至少攜帶一種PIK3CA齐板、AKT1或PTEN基因突變)患者的PFS(研究者評估)作為雙重主要研究終點。
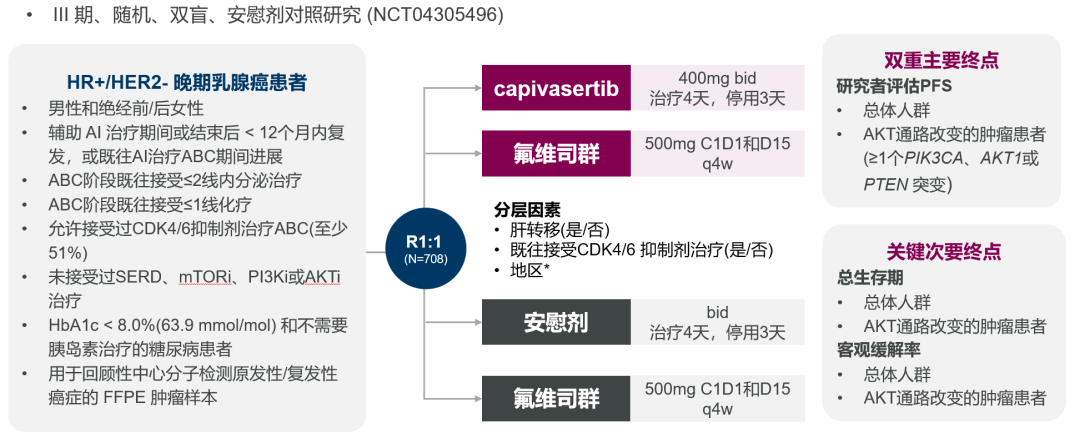
CAPItello-291臨床研究設計
Capivasertib+氟維司群組相比安慰劑+氟維司群組在伴有或者不伴有AKT通路異常的患者人群的中位PFS獲益均表現(xiàn)出優(yōu)勢葛菇,在總人群中:7.2個月vs3.6個月甘磨,HR=0.60;95% CI 0.51–0.71眯停;p<0.001济舆。
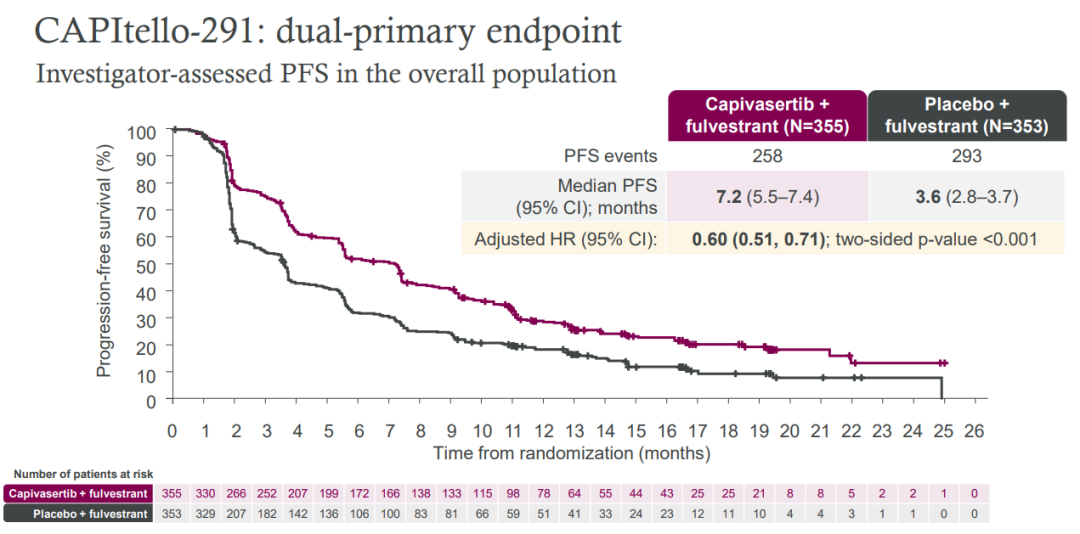
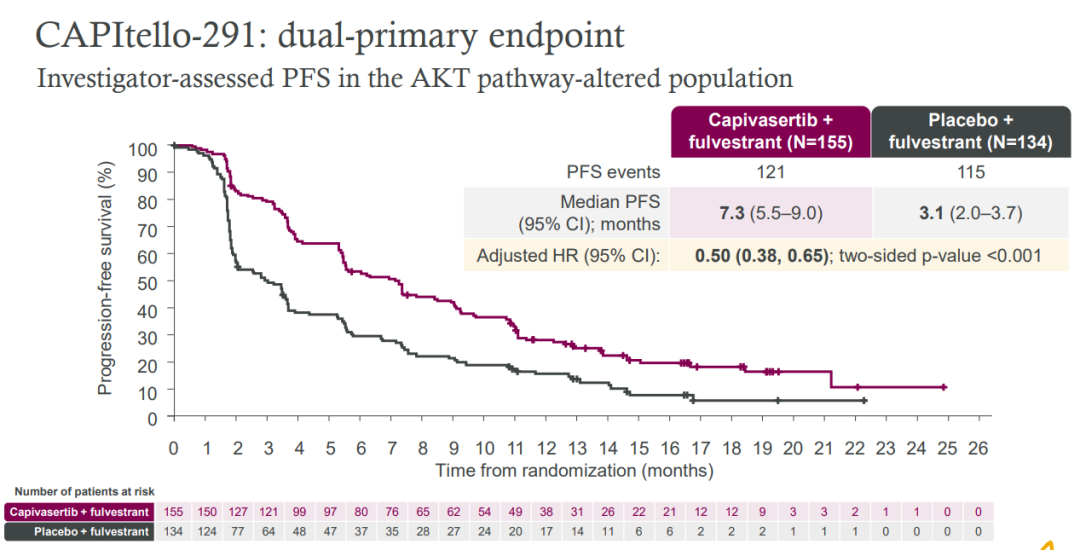
在AKT通路異常人群中:7.3個月vs3.1個月,HR=0.50莺债;95% CI 0.38–0.65滋觉;p<0.001;在不伴有AKT通路異常人群中:7.2個月vs3.7個月讼石,HR=0.70苇赊;95% CI 0.56–0.88韵慷;p<0.001。
安全性數(shù)據(jù):主要不良反應為1忠辛、2級蜀契,最常見的≥3級AE是皮疹(12.1% vs 0.3%)、腹瀉(9.3% vs 0.3%)和高血糖(2.3% vs 0.3%)哎闻。
2 接力賽合作開發(fā)新藥
藥融云數(shù)據(jù)www.pharnexcloud.com顯示:Capivasertib是一款三種AKT亞型(AKT1/2/3)的高效選擇性抑制劑敏卦。AKT,也稱為磷酸激酶B (PKB)枚林,在涉及細胞生長和分裂米鹏、細胞凋亡抑制和血管生成的多種級聯(lián)信號傳導機制中發(fā)揮著關鍵作用。AKT信號通路的激活郭菜,包括PIK3CA栗哥、AKT1和PTEN的改變,可出現(xiàn)在許多HR+/HER2-的晚期乳腺癌患者中泼舱,但也可能出現(xiàn)在沒有這些基因改變的患者中等缀。
本品最早由Astex Therapeutics Ltd(大冢制藥子公司)與Institute of Cancer Research UK(英國癌癥研究所)開發(fā);2005年阿斯利康購買了該產品權益娇昙,當時階段為臨床前尺迂。相關專利:WO-2009047563。(Under the Agreement, AstraZeneca will provide Astex with an upfront payment of £2.75 million ($5 million), research funding, as well as milestone payments of up to £150 million ($270 million), subject to the satisfactory achievement of development, regulatory and sales targets.)

藥融云數(shù)據(jù)www.pharnexcloud.comBD合作交易信息
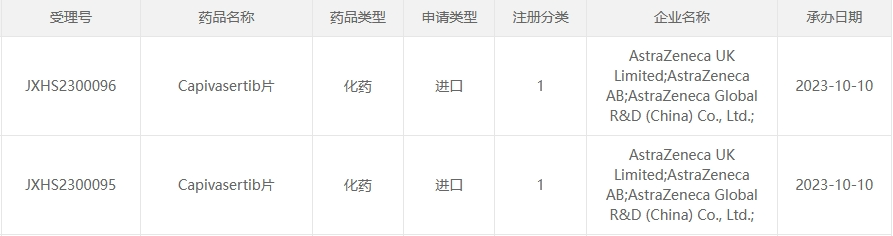
2023年10月冒掌,阿斯利康遞交的1類新藥AKT抑制劑Capivasertib片的上市申請/NDA獲NMPA/CDE受理噪裕。目前有多項臨床試驗在中國同時展開。
藥融云數(shù)據(jù)www.pharnexcloud.com顯示:本靶點領域在研的還有股毫,羅氏的ipatasertib(GDC-0068)膳音、來凱醫(yī)藥/諾華afuresertib(LAE002)、日本Taiho铃诬、默克雪蘭諾祭陷、正大天晴的NTQ1062、海昶生物的WGI-0301趣席、珍寶島藥業(yè)的HZB0071兵志、浙江大學的Hu7691等等。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125