
 研發(fā)追蹤
研發(fā)追蹤
 凱萊英藥聞
凱萊英藥聞  2023-12-04
2023-12-04
 1915
1915
2023年11月27日,專注于嚴重罕見病和癌癥的生物制藥公司SpringWorks Therapeutics宣布,美國食品和藥物管理局(FDA)已批準其口服γ分泌酶抑制劑OGSIVEO?(nirogacestat)用于需要全身治療的進展性硬纖維瘤成人患者崖蜜。
此前,F(xiàn)DA曾授予 nirogacestat 治療硬纖維瘤的突破性療法煤搜、快速通道和孤兒藥稱號炕常。此外床少,SpringWorks預(yù)計將于2024年上半年向歐洲藥品管理局提交OGSIVEO上市許可申請参匀。
硬纖維瘤是一種局部侵襲性和浸潤性軟組織腫瘤旭眼,可導(dǎo)致嚴重的發(fā)病率,嚴重可危及生命昭仓,且手術(shù)切除后的復(fù)發(fā)率高77%料害。
關(guān)于DeFi試驗結(jié)果
FDA批準 OGSIVEO 主要依據(jù)3期DeFi 試驗結(jié)果,該結(jié)果發(fā)表在 2023 年 3 月 9 日出版的《新英格蘭醫(yī)學(xué)雜志》 上凯辆。
DeFi(硬纖維瘤病/纖維瘤哺芪妗)試驗是一項 3 期臨床試驗,旨在評估一種名為 nirogacestat 的研究藥物在 18 歲以上患有進展性硬纖維瘤的人群中的安全性泞首、有效性和耐受性,根據(jù)試驗結(jié)果:
1、OGSIVEO達到了改善無進展生存期 (PFS) 的主要終點绳宰,與安慰劑相比有顯著的統(tǒng)計學(xué)改善掖饲,疾病進展風(fēng)險降低了 71%(危險比 (HR) = 0.29 (95% CI: 0.15, 0.55);P< 0.001)呀邢。
2洒沦、OGSIVEO治療組未達到中位生存期,安慰劑治療組的中位生存期為15.1個月价淌。根據(jù)RECIST v1.1標準確認的客觀反應(yīng)率(ORR)申眼,OGSIVEO為41%,安慰劑為8%(P<0.001)蝉衣;OGSIVEO治療組的完全反應(yīng)率為7%括尸,安慰劑為0%。
3病毡、無論基線特征如何濒翻,包括性別、腫瘤位置啦膜、腫瘤病灶有送、治療狀態(tài)、既往治療僧家、突變狀態(tài)和家族性腺瘤性息肉病史雀摘,OGSIVEO 的 PFS 和 ORR 均有改善宜柱。
4、OGSIVEO還顯示出患者報告結(jié)果(PROs)的早期和持續(xù)改善编喊,包括疼痛(p<0.001)拣薄、類脂樣腫瘤特異性癥狀(p<0.001)、身體/角色功能(p<0.001)和總體健康相關(guān)生活質(zhì)量(p≤0.01)呀胁。
5招狈、在接受OGSIVEO治療的患者中,最常見的不良事件(>15%)是腹瀉殖吧、卵巢毒性类棍、皮疹、惡心牧返、疲勞堡迷、口腔炎、頭痛弥铸、腹痛骇幽、咳嗽、脫發(fā)脸候、上呼吸道感染和呼吸困難穷娱。OGSIVEO 具有可控的安全性和耐受性。
關(guān)于OGSIVEO?
OGSIVEO?是一種口服运沦、選擇性小分子γ分泌酶抑制劑泵额,γ 分泌酶可切割多種跨膜蛋白,包括 Notch携添,這些蛋白被認為在激活有助于 生長的途徑中發(fā)揮作用 硬纖維瘤和卵巢顆粒細胞瘤嫁盲。
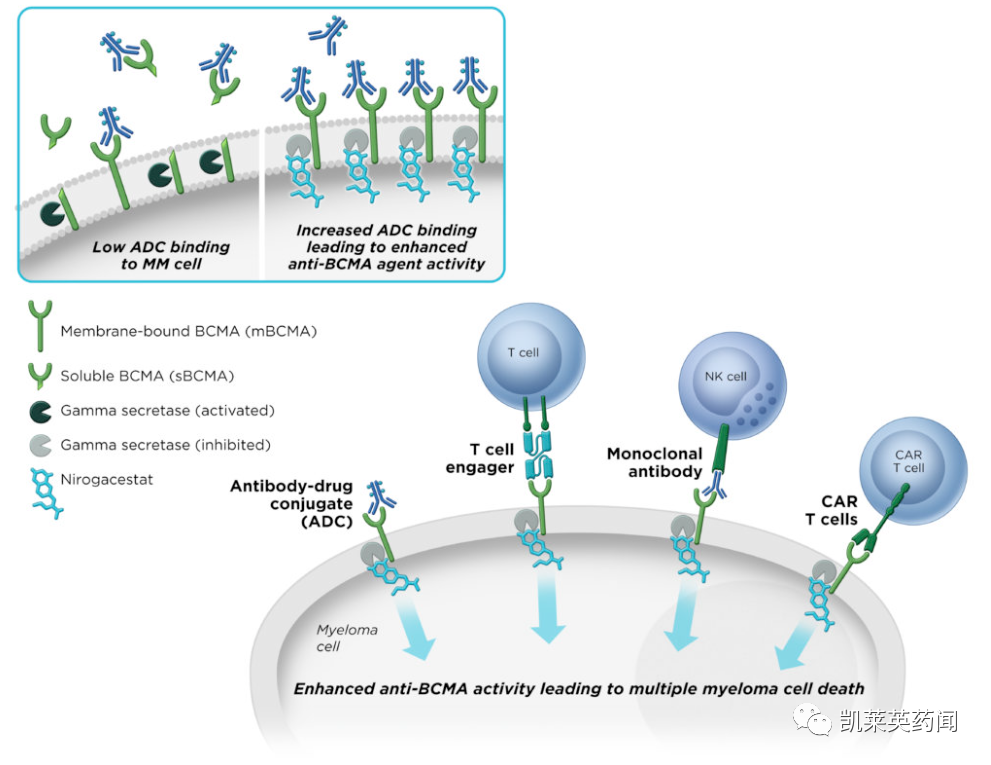
已證明γ 分泌酶可以切割 BCMA,BCMA 是一種在多發(fā)性骨髓瘤細胞上特異性表達的治療靶標烈掠。SpringWorks認為羞秤,通過用nirogacestat抑制γ分泌酶,膜結(jié)合的BCMA可以保留在骨髓瘤細胞表面左敌,從而增加靶密度瘾蛋,同時降低可溶性BCMA的水平,這可能會干擾BCMA靶向治療的活性母谎。nirogacestat與BCMA靶向治療聯(lián)合使用可能會增加其活性并改善多發(fā)性骨髓瘤患者的預(yù)后瘦黑。
因此除硬纖維瘤以外,SpringWorks 還在與業(yè)界和學(xué)術(shù)界的領(lǐng)先企業(yè)合作奇唤,評估將nirogacestat 作為卵巢顆粒細胞瘤患者和多發(fā)性骨髓瘤患者的潛在治療藥物趾倾,作為幾種B細胞成熟抗原(BCMA)聯(lián)合治療方案的一部分。
關(guān)于 SpringWorks
SpringWorks成立于 2017 年,是一家處于商業(yè)化階段的生物制藥公司绑功,采用精準醫(yī)療方法為嚴重罕見病和癌癥患者開發(fā)和提供改變生命的藥物泵易。擁有多元化的腫瘤靶向藥物管線,涵蓋實體瘤和血液腫瘤窥书,包括罕見腫瘤類型和高發(fā)碴厂、基因定義癌癥的臨床試驗。成立至今與強生偷被、輝瑞刮盗、GSK、艾伯維逝遣、百濟神州等跨國藥企達成合作书县。OGSIVEO?是SpringWorks首個獲得FDA批準的療法。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125