
 研發(fā)追蹤
研發(fā)追蹤
 星耀研究院
星耀研究院  2023-12-11
2023-12-11
 2594
2594
2023年12月7日/醫(yī)麥客--星耀研究院新聞 PharmaBIGStar News/--近日,TCR-T細胞療法先驅企業(yè)Adaptimmune宣布蛹拜,已經(jīng)向美國FDA完成其TCR-T細胞療法Afami-cel的生物制品許可申請(BLA)的滾動式遞交過程蕊连,用于治療晚期滑膜肉瘤悯女。Afami-cel符合優(yōu)先審查資格掺栅,這將縮短FDA對申請的審查時間至8個月额衙,
Afami-cel是一款MAGE-A4靶向的TCR-T細胞療法慎陵,MAGE-A4作為癌睪丸抗原腥刹,在多種腫瘤組織中高表達,該產(chǎn)品也是全球首款申報上市的TCR-T細胞療法宴卖。FDA已授予其治療晚期軟組織肉瘤的孤兒藥資格(ODD)和晚期滑膜肉瘤的再生醫(yī)學高級療法(RMAT)資格滋将。
本次申報上市基于關鍵試驗SPEARHEAD-1的隊列1的陽性數(shù)據(jù),SPEARHEAD-1是一項針對晚期滑膜肉瘤或粘液樣/圓形細胞脂肪肉瘤(MRCLS)患者的2期開放標簽試驗,旨在評估TCR-T產(chǎn)品afami-cel的療效随闽、安全性和耐受性父丰。
根據(jù)Adaptimmune于2022結締組織腫瘤學會(CTOS)年會上公布的SPEARHEAD-1中隊列1的最終分析數(shù)據(jù)。截至2022年8月29日掘宪,52例患者(44例滑膜肉瘤蛾扇,8例MRCLS)接受了afami-cel治療,ORR為36.5%(其中滑膜肉瘤為38.6%添诉,MRCLS為25.0%)屁桑,疾病控制率為88.4%医寿±父埃滑膜肉瘤的緩解中位持續(xù)時間約為12個月。
與先前接受過兩次或兩次以上治療的滑膜肉瘤患者的歷史中位總生存期(mOS)<12個月相比靖秩,SPEARHEAD-1患者的中位總生存期(mOS)約為17個月卢操。
70%對afami-cel有反應的晚期滑膜肉瘤患者在治療后兩年內(nèi)仍然存活。毒性包括細胞因子釋放綜合征和可逆的血液毒性件父,與之前的研究結果一致企奔,表明其安全性在可接受范圍之內(nèi)。另外夹它,該研究的隊列2整體緩解率與隊列1幾乎相同(隨訪成熟時將報告數(shù)據(jù))妖奕。為探討TCR-T療法發(fā)展,2024 IBI EXPO 生物創(chuàng)新藥產(chǎn)業(yè)大會特設第六屆腫瘤免疫細胞治療技術研討會恢儡,匯聚TCR-T領域行業(yè)大咖共同探尋未來的發(fā)展方向!
華盛頓大學醫(yī)學院醫(yī)學和兒科學教授Brian A. Van Tine博士說:“CTOS 2023上顯示的額外數(shù)據(jù)表明窄栓,與一年前相比,接受afami-cel治療的滑膜肉瘤患者的長期療效有所提高组莲。該產(chǎn)品有望成為滑膜肉瘤的首創(chuàng)療法笙亿,持這種產(chǎn)品廣泛使用的呼聲很高≈浔”
國內(nèi)TCR-T進展迅速
作為一款具有開創(chuàng)性意義的細胞治療藥物炕烈,afami-cel的上市之路并不太順利,該產(chǎn)品因為多種不同因素一次次推遲上市渔硫,但是好在歷盡千帆皱坛,該產(chǎn)品終于走到了商業(yè)化前夕。而其每跨越一道障礙豆巨,也給后來者提供了寶貴的經(jīng)驗剩辟。一旦這種細胞療法走通了商業(yè)化之路,也就意味著整個賽道都將迎來高速發(fā)展搀矫。
從TIL療法的國內(nèi)管線進展來看抹沪,國內(nèi)TCR-T進展迅速。香雪制藥瓤球、百吉生物融欧、天科雅敏弃、普瑞金、深圳賓德噪馏、來恩生物麦到、泛恩生物、華夏英泰欠肾、立凌生物瓶颠、可瑞生物等多家藥企布局了這一賽道。并且椭吠,在半年之內(nèi)已經(jīng)有多家企業(yè)取得了突破性進展捅青。
據(jù)了解,國際著名期刊Cell Reports Medicine刊發(fā)了香雪制藥的第一款TCR-T細胞藥物TAEST16001的1期臨床研究成果炬锦,該產(chǎn)品適應癥為軟組織肉瘤豺孤,I期臨床研究腫瘤客觀緩解率(ORR)達到41.7%,中位無進展生存期(PFS)為7.2個月孝炫,中位緩解持續(xù)時間(DOR)為13.1個月凌秩,并已進入II期臨床研究。
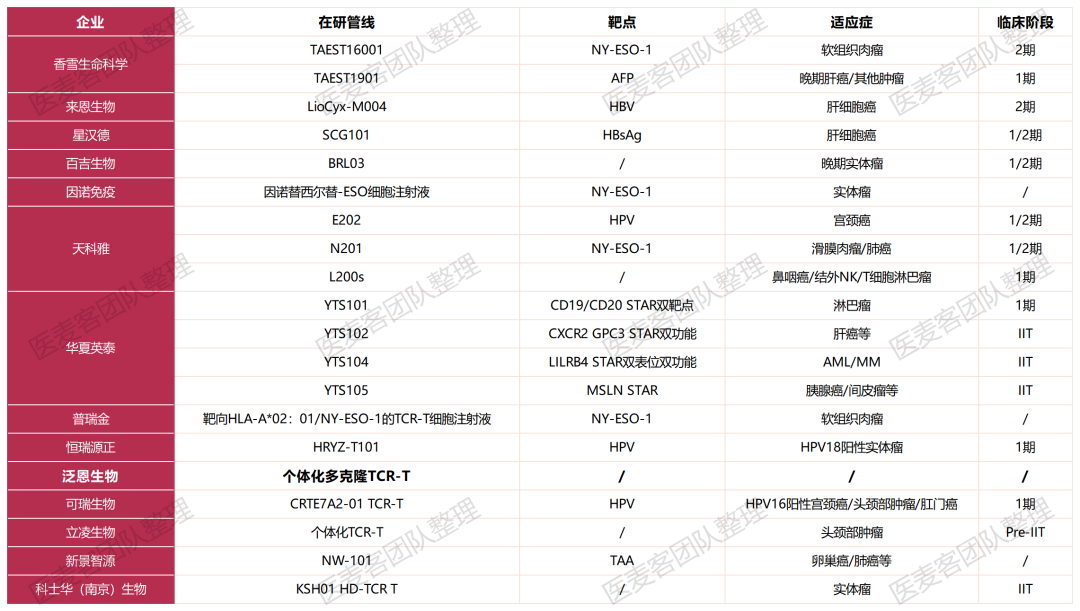
今年5月抽茸,基于恒瑞源正自主研發(fā)的ReGET平臺轉化出的首個針對中國人群高頻HLA的TCR-T細胞治療產(chǎn)品HRYZ-T101獲批臨床段许,適應癥是人乳頭瘤病毒18亞型陽性(HPV18)的實體瘤。
今年6月碍讼,星漢德生物在國際細胞與基因治療學會(ISCT)會議上展示了SCG101的最新臨床數(shù)據(jù):單劑量SCG101輸注后可根除100%的HBsAg+肝細胞驹毁,使得74.5%的肝腫瘤細胞減少。
2023年的ASCO大會上润申,天科雅公布了分泌免疫檢查點抑制劑的TCR-T細胞治療EBV陽性鼻咽癌的首次人體1/2期臨床試驗初步數(shù)據(jù):截至2023年1月销贝,2例患者(33.3%)部分緩解(PR),其中1例患者的緩解持續(xù)時間長達9個月呻纹,3例患者(50%)穩(wěn)定疾捕焉(SD)。
2023年9月雷酪,百吉生物第三條全球首創(chuàng)產(chǎn)品管線BRL03 I/II期臨床試驗申請獲得美國FDA批準淑仆,用于治療多種晚期實體瘤(包括肺癌、胃癌等)哥力。值得一提的是蔗怠,BRL03還是百吉生物研發(fā)的首款進入臨床的TCR-T產(chǎn)品,且該產(chǎn)品已經(jīng)在國內(nèi)申報臨床吩跋。
今年11月寞射,可瑞生物首個免疫細胞治療產(chǎn)品CRTE7A2-01 TCR-T細胞注射液獲得臨床試驗批準通知書,這標志著可瑞生物正式邁向注冊臨床試驗的開展階段。此外桥温,多家國內(nèi)企業(yè)在這一賽道取得了許多突破性的進展引矩,這也意味著國內(nèi)TCR-T產(chǎn)業(yè)的逐漸成熟。
值得一提的是侵浸,跨國巨頭在這一領域出現(xiàn)了一定分歧旺韭,GSK終止了與Lyell Immunopharm、Adaptimmune林乍、Immatics的細胞療法合作項目宙锡,三項終止的合作均屬于TCR-T細胞療法領域。而阿斯利康于去年11月收購了一家TCR-T療法企業(yè)戒腔,以加速在實體瘤TCR-T細胞療法領域的布局狐昆,最高收購金額達到3.2億美元。在GSK看來臂沽,細胞療法領域如今已經(jīng)太過擁擠挺教,而擴展到實體腫瘤的前景比最初想象的更具挑戰(zhàn)性∠鸶辏總的來看,TCR-T細胞療法挑戰(zhàn)與機遇并存昌漏,跨國藥企態(tài)度出現(xiàn)分歧也會醞釀出一些新的機會掷雪,而把握這些機會的關鍵在于管線創(chuàng)新和差異化。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125