
 研發(fā)追蹤
研發(fā)追蹤
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2023-12-18
2023-12-18
 2347
2347
12 月 13 日逃魄,安進(jìn)宣布毛雇,其在研 DLL3/CD3 雙抗 Tarlatamab 的 BLA 申請獲 FDA 受理并獲優(yōu)先審評資格莺债,針對晚期 NSCLC迈着。PDUFA 決定日期在 2024 年 6 月 12 日彼念。
來自:安進(jìn)官網(wǎng)
Tarlatamab/AMG757 是安進(jìn)/百濟(jì)合作開發(fā)的一款靶向 DLL3 和 CD3 的潛在「first-in-class」雙特異性 T 細(xì)胞銜接蛋白(BiTE)袱蔓。
該 BLA 的提交是基于 II 期臨床 DeLLphi-301 研究結(jié)果坤乌。該研究旨在評估既往接受過治療的 SCLC 患者每 2 周一次靜脈注射 tarlatamab(10 mg/100 mg) 的抗腫瘤活性和安全性媒埃。主要研究終點為經(jīng) BICR 評估的 ORR菜碌。
220 例受試者接受了 Tarlatamab 治療。結(jié)果顯示,中位隨訪時間為 10.6 個月兰粉,10 mg 劑量的 ORR 為 40.0%故痊,中位 PFS 為 4.9 個月,中位 OS 為 14.3 個月玖姑,中位 DoR 未達(dá)到愕秫,在對 Tarlatamab 治療有應(yīng)答的患者中,57.5% 的患者在數(shù)據(jù)截止時至少出現(xiàn) 6 個月應(yīng)答焰络,55% 的應(yīng)答仍在進(jìn)行中戴甩。
安全性方面,與 1 期臨床試驗相比闪彼,未觀察到新的安全性信號甜孤。最常見不良事件包括細(xì)胞因子釋放綜合征、食欲下降和發(fā)熱畏腕。10 mg 組(1%)的 3 級細(xì)胞因子釋放綜合征發(fā)生率低于 100 mg 組(6%)缴川。因治療相關(guān)不良事件而停用 Tarlatamab 的患者比例較低(3.0%:10 mg;3.4%:100 mg)描馅。
Tarlatamab 當(dāng)前已進(jìn)入 III 期臨床階段把夸,正在開展一項 III 期 DeLLphi-304 研究,旨在評估二線治療 SCLC 患者中比較 Tarlatamab 單藥與標(biāo)準(zhǔn)化療的療效脸夸。計劃全球入組 500 人尉武,今年 5 月已完成首例受試者的入組工作;7 月也已經(jīng)啟動了該項研究的國內(nèi)部分(登記號:CTR20232049)米法。
此外僧憾,安進(jìn)剛于今年 11 月啟動另一項 III 期臨床 DeLLphi-306,針對同步放化療后局限期小細(xì)胞肺癌(LS-SCLC)患者短户。預(yù)計明年 1 月完成首例受試者的入組工作荐呵。
據(jù) Insight 數(shù)據(jù)庫顯示,全球共有 5 款靶向 DLL3 的雙特異性抗體進(jìn)入臨床階段唇锡,包括 4 款 DLL3/CD3 雙抗蔬聚。進(jìn)展最快的當(dāng)屬 Tarlatamab,其余處于早期研發(fā)階段矗绅。
全球進(jìn)入臨床階段 5 款靶向 DLL3 的雙特異性抗體
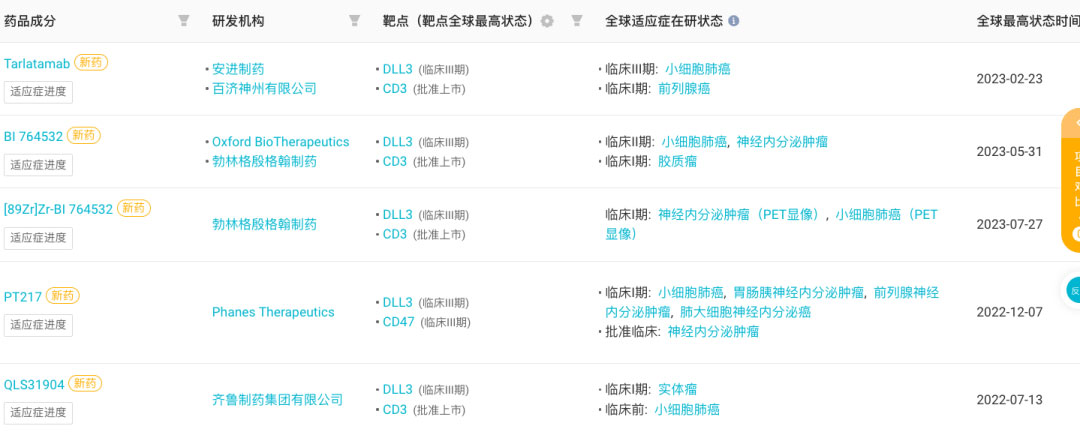
來自:Insight 數(shù)據(jù)庫網(wǎng)頁版

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊