
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥筆記
醫(yī)藥筆記  2023-12-29
2023-12-29
 2290
2290
2023年12月26日辙纬,安進(jìn)宣布FDA完成對(duì)其KRAS G12C抑制劑Sotorasib謀求完全批準(zhǔn)sNDA的審評(píng)蛙吏,F(xiàn)DA拒絕完全批準(zhǔn)嚎朽,要求進(jìn)行額外的驗(yàn)證臨床試驗(yàn)骑祟,并不晚于2028年2月完成楔脯。

2023年10月5日植碳,F(xiàn)DA就安進(jìn)KRAS G12C抑制劑Sotorasib的三期驗(yàn)證臨床組織了專家委員會(huì)進(jìn)行論證沼昵。
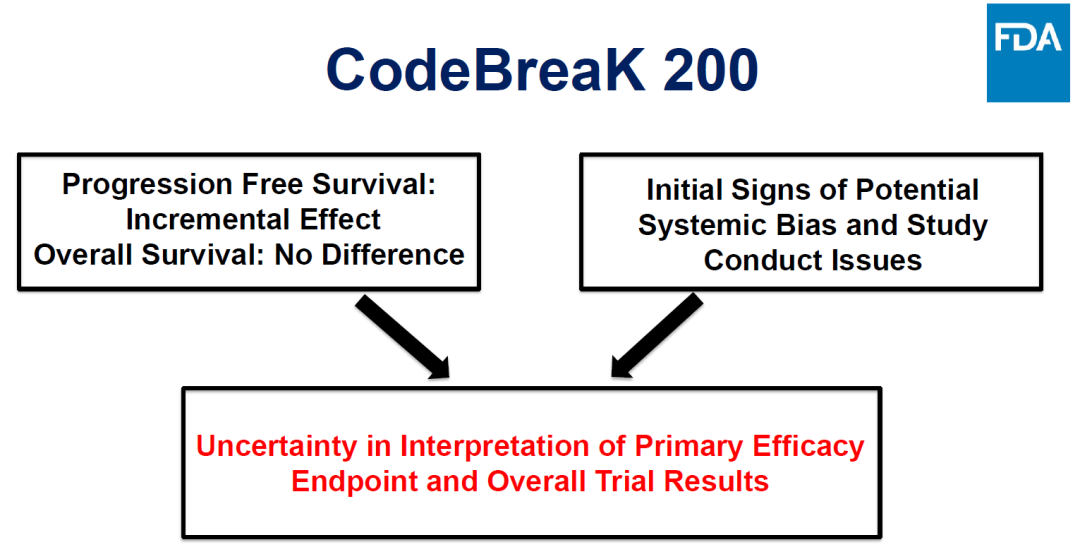
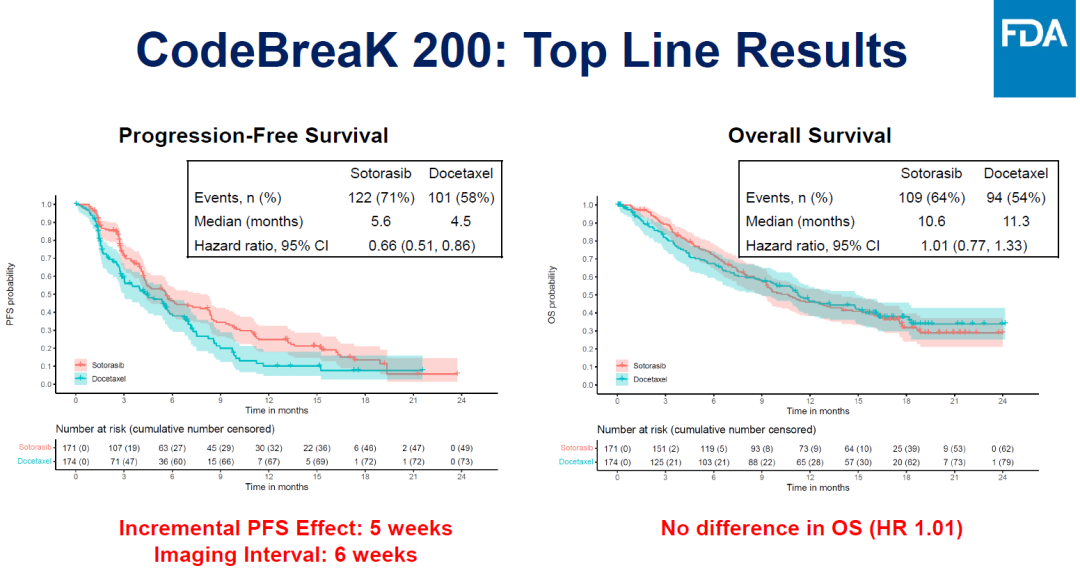
Sotorasib于2021年獲得加速批準(zhǔn)斩角,此次討論的是驗(yàn)證臨床CodeBreak 200的臨床數(shù)據(jù)夷呐。相比于多西他賽,Sotorasib治療組PFS有改善伶丐,OS沒(méi)有區(qū)別悼做,總體來(lái)看主要療效終點(diǎn)不明確。
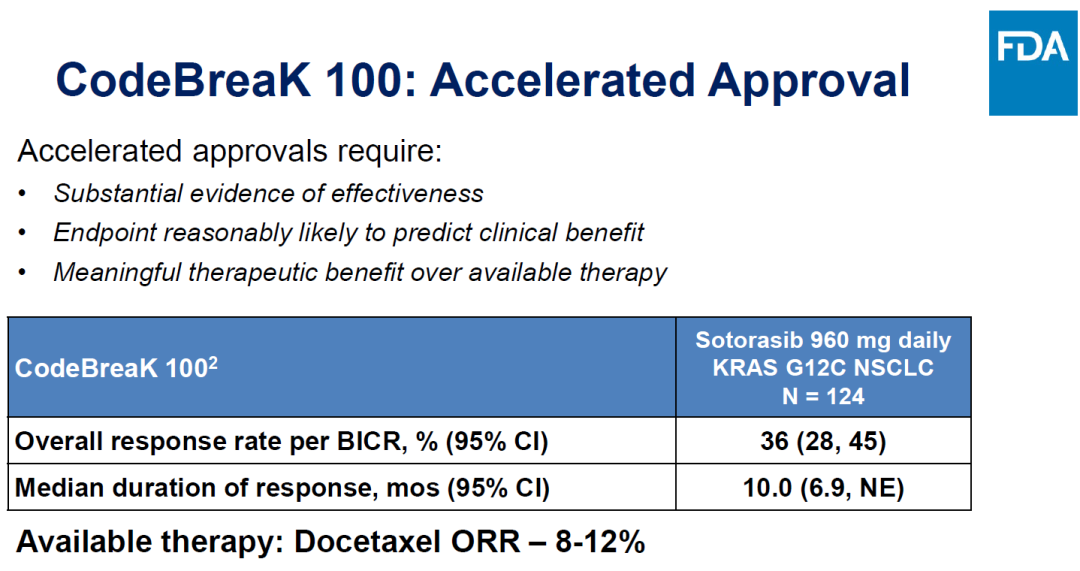
Sotorasib此前加速批準(zhǔn)依靠的是CodeBreak 100的數(shù)據(jù)哗魂,ORR為36%肛走,mDOR為10個(gè)月。
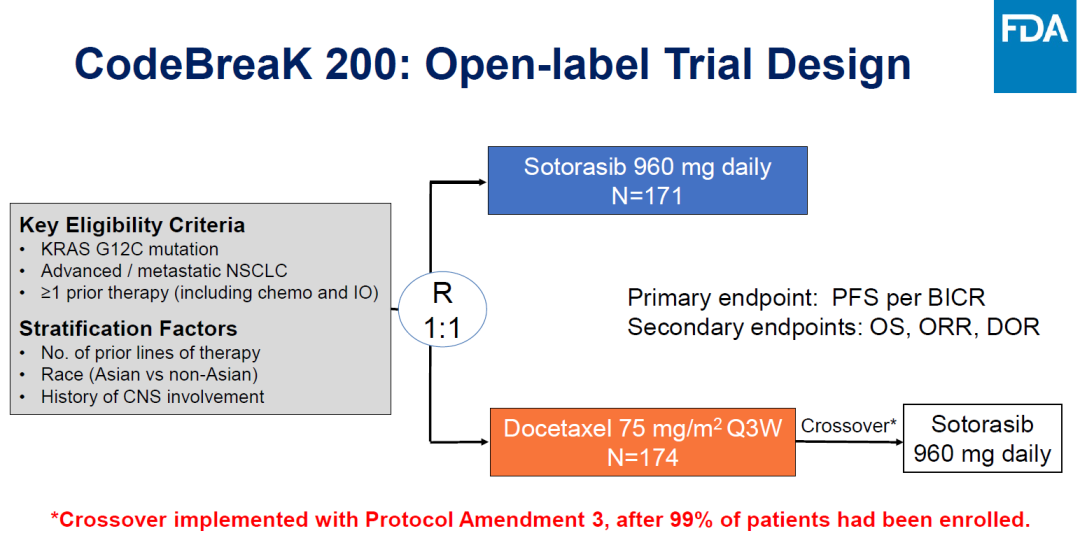
驗(yàn)證臨床CodeBreak 200的臨床設(shè)計(jì)如下啡彬。
Sotorasib與多西他賽治療組羹与,mPFS分別為5.6個(gè)月、4.5個(gè)月庶灿,OS分別為10.6個(gè)月纵搁、11.3個(gè)月。
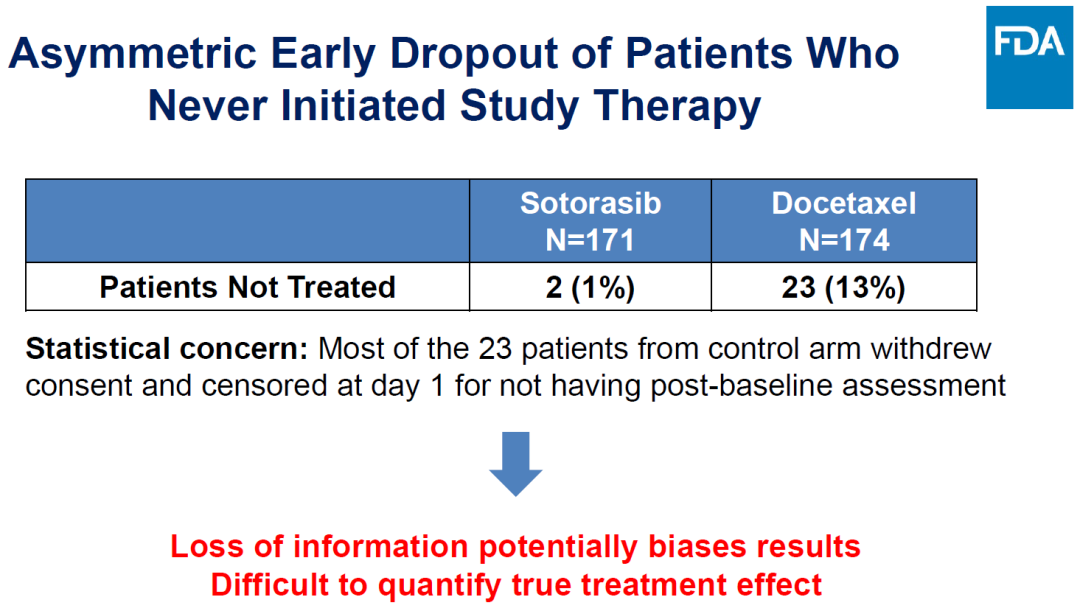
多西他賽組23例患者脫落往踢,導(dǎo)致真實(shí)療效難于評(píng)價(jià)腾誉。
FDA專家委員會(huì)認(rèn)為Sotorasib的療效能否確定是存疑的。

總結(jié)
上述審評(píng)會(huì)議上專家組最終以2票贊同峻呕,10票反對(duì)的結(jié)果利职,認(rèn)為CodeBreaK 200的主要研究終點(diǎn)(盲態(tài)獨(dú)立中心評(píng)估 BICR]的無(wú)進(jìn)展生存期PFS無(wú)法被可靠地解釋。需要注意的是瘦癌,此次會(huì)議討論的并非獲益-風(fēng)險(xiǎn)評(píng)價(jià)撼盈,而是臨床設(shè)計(jì)和實(shí)施的問(wèn)題。因此填丢,F(xiàn)DA拒絕完全批準(zhǔn)Lumakras节讹,并要求進(jìn)行額外臨床驗(yàn)證。須知這樣的低級(jí)錯(cuò)誤對(duì)于MNC來(lái)說(shuō)敞灸,也是不太常見(jiàn)的漾肩,更多時(shí)候我們看到的是因?yàn)樯a(chǎn)問(wèn)題而非臨床設(shè)計(jì)問(wèn)題導(dǎo)致CRL贫介。

 研發(fā)追蹤
研發(fā)追蹤
 藥時(shí)代
藥時(shí)代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽