
 研發(fā)追蹤
研發(fā)追蹤
 2016-11-24
2016-11-24
 5375
5375
來源: 生物制藥??? 2016-11-24
同日批準(zhǔn)
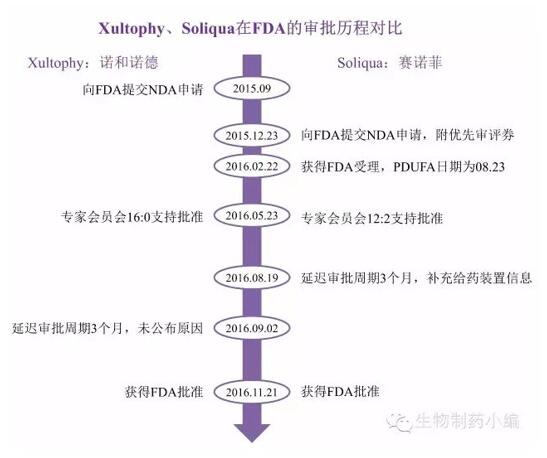
2016年11月21日姜钳,FDA同日批準(zhǔn)2款基礎(chǔ)胰島素/GLP-1受體激動劑藥物:諾和諾德Xultophy糯驯、賽諾菲Soliqua。
?
Xultophy原本在2014年9月就已經(jīng)登錄歐洲市場,在美國則因?yàn)?/span>FDA顧慮德谷胰島素的心血管風(fēng)險谍益,直到2015年9月才向FDA提交上市申請。賽諾菲為了爭奪美國市場第一款基礎(chǔ)胰島素/GLP-1受體激動劑,押上了2.45億美元買自Retrophin的優(yōu)先審評券,最終卻因?yàn)榻o藥裝置問題無奈延遲理茎。FDA的策略更富有戲劇性,選擇在同一天批準(zhǔn)兩款類似藥物管嬉。
?
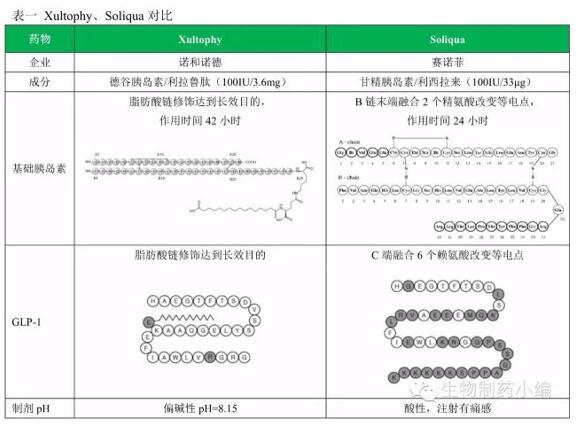
兩藥比較
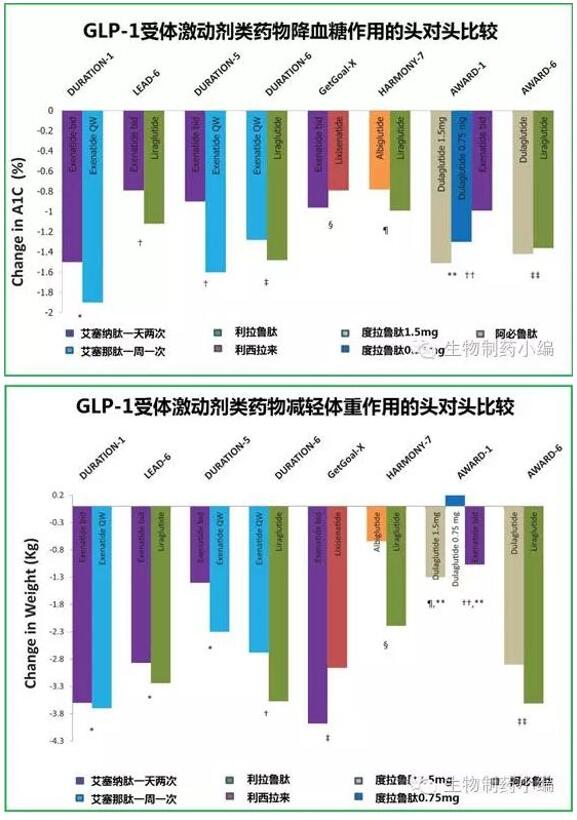
從藥效作用和減輕體重作用來看皂林,利拉魯肽都稍強(qiáng)于艾塞納肽,而利西拉來都稍弱于艾塞納肽蚯撩。利拉魯肽已經(jīng)通知GLP-1受體激動劑市場多年丑辖,同時前段時間已經(jīng)證實(shí)具有心血管收益,成為繼恩格列凈后第二個證實(shí)有心血管獲益的糖尿病藥物夷朽。
?
?
基礎(chǔ)胰島素方面,德谷胰島素的低血糖風(fēng)險更低元粹、注射時間更靈活(每天注射一次即可熄朴,不限時間),盡管仍有甲狀腺C細(xì)胞腫瘤的黑框警告勺激,仍將對甘精胰島素的市場產(chǎn)生強(qiáng)大沖擊雾鸠。
?
小編總結(jié)
甘精胰島素有先發(fā)優(yōu)勢,但市場地位受到德谷胰島素及眾多仿制品的沖擊而快速下降捎滴。利拉魯肽對利西拉來的優(yōu)勢則非常明顯纪娄。總體來看悉契,Soliqua因給藥裝置問題將先發(fā)優(yōu)勢得而復(fù)失實(shí)屬尷尬启毁,后續(xù)競爭中Xultrophy的優(yōu)勢或?qū)⒏用黠@。
?
值得注意憔辞,同日Intarcia向FDA提交了一年一次的GLP-1受體激動劑皮下微型泵裝置ITCA650的NDA申請页衙,該領(lǐng)域的競爭將更加多樣化。

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 94
94

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 95
95

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 94
94
 熱門資訊
熱門資訊