
 研發(fā)追蹤
研發(fā)追蹤
 Insight數(shù)據(jù)庫
Insight數(shù)據(jù)庫  2024-02-26
2024-02-26
 1333
1333
2 月 20 日,默沙東宣布咆课,F(xiàn)DA 已接受 K 藥的補(bǔ)充生物制品許可申請(sBLA)并授予優(yōu)先審評資格惧圆,用于聯(lián)合標(biāo)準(zhǔn)化療(卡鉑和紫杉醇)治療原發(fā)性晚期或復(fù)發(fā)性子宮內(nèi)膜癌患者。PDUFA 日期為 2024 年 6 月 21 日谈芬。
K 藥有望將成為首個晚期子宮內(nèi)膜癌(無論 MMR 狀態(tài)如何)一線免疫療法搓茬。

來自:默沙東官網(wǎng)
此次 sBLA 主要基于 III 期臨床 NRG-GY018 研究結(jié)果數(shù)據(jù)兽掰。
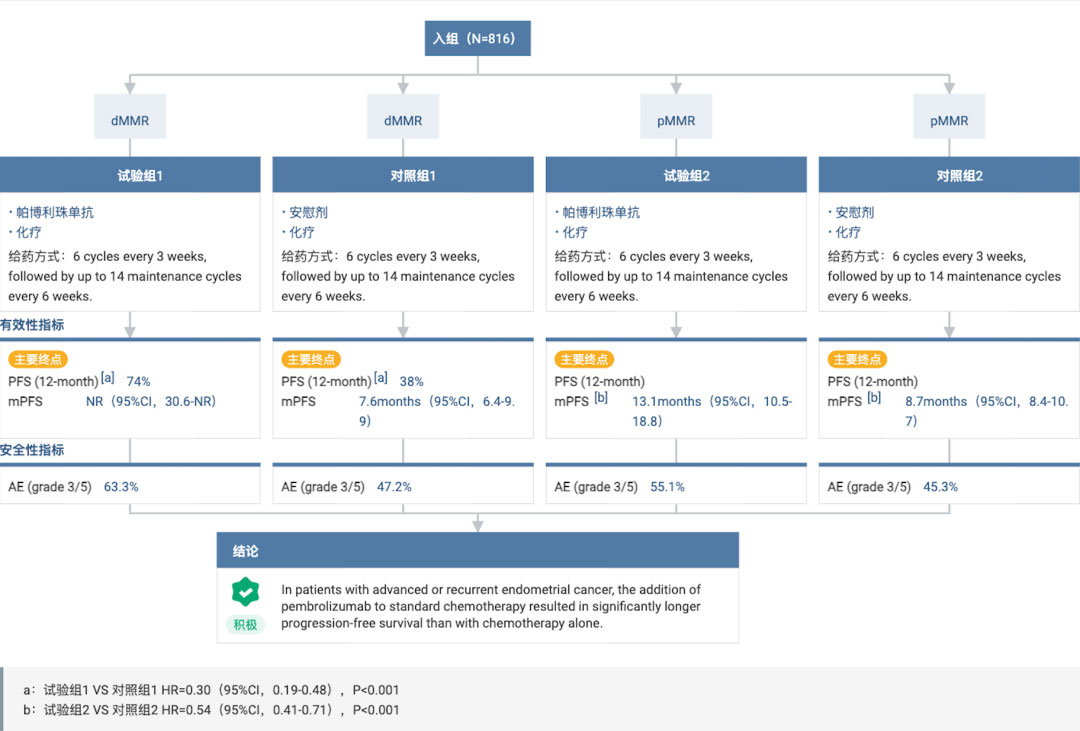
NRG-GY018 研究旨在評估 K 藥聯(lián)合化療對照安慰劑聯(lián)合化療在錯配修復(fù)功能正常(pMMR)型和錯配修復(fù)缺陷(dMMR)型原發(fā)性晚期或復(fù)發(fā)性子宮內(nèi)膜癌患者中的療效和安全性竿滨。研究的主要終點為 PFS佳恬;次要終點包括安全性、總生存期等于游。
去年 3 月在 NEJM 期刊上公布的結(jié)果數(shù)據(jù)顯示:K 藥聯(lián)合標(biāo)準(zhǔn)化療相比安慰劑聯(lián)合標(biāo)準(zhǔn)化療毁葱,可顯著降低患者疾病進(jìn)展或死亡風(fēng)險 70%(dMMR 隊列)和 46%(pMMR 隊列)。具體來看:
該研究共有 816 名受試者被納入研究最終分析贰剥,包括 dMMR 隊列 225 名倾剿,pMMR 隊列 591 名。
在 dMMR 隊列中蚌成,中位隨訪 12 個月時前痘,K藥+化療組、安慰劑+化療組的患者中位 PFS 分別為:尚未達(dá)到(95%CI:30.6-NR)秕刊、7.6 個月(95%CI:6.4-9.9)旋囤;與安慰劑+化療相比,K藥+化療可將患者的疾病進(jìn)展或死亡風(fēng)險顯著降低70%(HR=0.30戏筹;95%CI:0.19-0.48;P<0.00001)嫁昌。
而在 pMMR 隊列中缓万,中位隨訪 7.9 個月,K 藥+化療組锁荚、安慰劑+化療組患者的中位 PFS 分別為 13.1 個月和 8.7 個月蔫狰;K 藥+化療將患者的疾病進(jìn)展或死亡風(fēng)險顯著降低了 46%(HR=0.54;95% CI:0.41~0.71滴练;P<0.001)芋妻。
安全性方面,K 藥與既往臨床試驗中的安全性一致摊桅。在 dMMR 隊列中昭礁,K 藥聯(lián)合化療組的不良事件(AE)發(fā)生率為 98.2%,3 級及以上 AE 的發(fā)生率為 63.3%,而安慰劑聯(lián)合化療組則分別為 99.1% 和 47.2%剪撬;在 pMMR 隊列中摄乒,K 藥聯(lián)合化療組的 AE 發(fā)生率為 93.5%(vs 安慰劑聯(lián)合化療組為 55.1%),3 級及以上 AE 為93.4%(vs 安慰劑聯(lián)合化療組為 45.3%)残黑。
NRG-GY018 研究結(jié)果
來自:Insight 數(shù)據(jù)庫網(wǎng)頁版
此前 K 藥已獲 FDA 批準(zhǔn)了 2 項針對子宮內(nèi)膜癌的適應(yīng)證馍佑,分別為:
1)聯(lián)合侖伐替尼治療非微衛(wèi)星高度不穩(wěn)定(MSI-H)或 pMMR 型晚期子宮內(nèi)膜癌患者,該類患者既往接受過系統(tǒng)治療后出現(xiàn)疾病進(jìn)展且不適合進(jìn)行根治性手術(shù)或放療梨水;2)單藥治療 MSI-H 或 dMMR 型晚期子宮內(nèi)膜癌患者拭荤,該類患者既往接受過系統(tǒng)治療后出現(xiàn)疾病進(jìn)展且不適合進(jìn)行根治性手術(shù)或放療。
針對子宮內(nèi)膜癌疫诽,據(jù) Insight 數(shù)據(jù)庫顯示舅世,默沙東登記啟動了 7 項 III 期臨床研究,當(dāng)前仍在積極推進(jìn) K 藥單藥一線療法(KEYNOTE-C93/ENGOT-en15/GOG-3064)以及聯(lián)合化療輔助療法(KEYNOTE-B21/ENGOT-en11/GOG-3053)等進(jìn)展踊沸。
2023 年 K 藥全年銷售額已達(dá)到 250.11 億美元歇终,成功問鼎「藥王」寶座。當(dāng)前逼龟,除拓展更多癌種外评凝,默沙東還早早的備好更多糧草,已從科倫秦代、第一三共引進(jìn)多款 ADC 新藥潦号,朝著「PD-1 + ADC」聯(lián)用時代進(jìn)軍。Evaluate Pharma 曾預(yù)期 K 藥未來峰值銷售額有望達(dá)到 300 億美元量級蚯景。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊