
 研發(fā)追蹤
研發(fā)追蹤
 2016-11-23
2016-11-23
 5110
5110
來源:藥明康德??? 2016-11-23
昨日,Janssen?Biotech公司宣布褂傀,美國FDA已經(jīng)批準DARZALEX(daratumumab)與lenalidomide(一種免疫調(diào)節(jié)劑)和dexamethasone窟著,或者與bortezomib(一種蛋白酶體抑制劑纽竣,PI)和dexamethasone用于聯(lián)合治療多發(fā)性骨髓瘤(multiple?myeloma)臂沽,這些患者至少已經(jīng)接受過一次先前治療呐粘。臨床研究曾表明敢俭,與單用lenalidomide和dexamethasone相比岖酸,DARZALEX聯(lián)合lenalidomide和dexamethasone治療多發(fā)性骨髓瘤涉捂,先前經(jīng)治患者的疾病進展或死亡的風險降低了63%(危險比[HR]=0.37;?95%CI?[0.27,0.52]奄刊,p<0.0001)。與單用bortezomib和dexamethasone相比狐绽,采用bortezomib污祭、dexamethasone锐校、DARZALEX聯(lián)合療法的經(jīng)治患者的疾病進展或死亡的風險降低了61%(HR=0.39;?95%CI?[0.28,0.53],p<0.0001)慨蜒。lenalidomide和dexamethasone目前是兩種最廣泛使用的多發(fā)性骨髓瘤標準治療制劑矮按。<>
多發(fā)性骨髓瘤是一種不可治愈的血癌,源于惡性漿細胞在骨髓中不受控制地生長歉羹。2015年全球范圍內(nèi)膨泄,估計12.4萬多例患者被診斷出患有多發(fā)性骨髓瘤,8.7萬多名病人死于該疾病帅挫。雖然一些多發(fā)性骨髓瘤患者沒有明顯癥狀段丸,大多數(shù)患者由于骨折或骨骼疼痛、低紅細胞計數(shù)抡草、疲勞饰及、鈣含量升高、腎臟問題或感染等癥狀而被確診康震。
靜脈注射用DARZALEX是世界上首個獲批的CD38介導的溶細胞性抗體燎含。CD38是一種在多發(fā)性骨髓瘤細胞中高表達的細胞表面蛋白。DARZALEX被認為可以通過多種免疫介導的作用機制來誘導腫瘤死亡:包括互補依賴性細胞毒作用(CDC)腿短、抗體依賴性細胞介導的細胞毒作用(ADCC)和抗體依賴性細胞吞噬作用(ADCP)以及通過細胞凋亡(apoptosis)屏箍。該藥物于2015年11月首次被FDA批準作為部分多發(fā)性骨髓瘤患者的單一療法治療,他們曾接受過PI或免疫調(diào)節(jié)劑治療橘忱,或針對PI和免疫調(diào)節(jié)劑都是難治的赴魁。
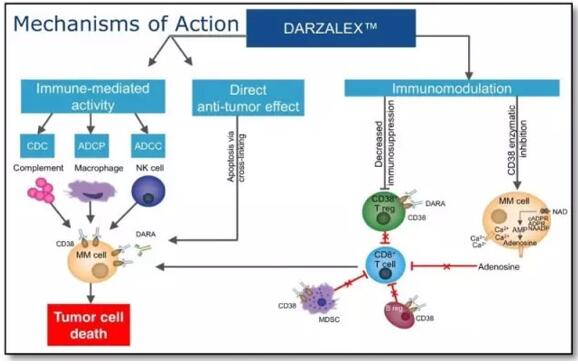
DARZALEX的作用機理(圖片來源:Seton?Hall?University)
昨天的批準有來自POLLUX?(MMY3003)?和CASTOR?(MMY3004)?兩個3期研究的積極數(shù)據(jù)支持。與標準護理方案lenalidomide和dexamethasone治療相比钝诚,加了DARZALEX后治療方案顯著改善無進展生存期(PFS)颖御,達到了臨床試驗的主要終點。這些臨床研究的更新數(shù)據(jù)結(jié)果將作為口頭報告形式在加州圣地亞哥即將舉行的第58屆美國血液學會(ASH)年會上得以公布敲长。
該批準是在2016年8月Janssen向FDA提交補充生物制劑許可申請(sBLA)三個月后得以完成的郎嫁。FDA也曾于2016年7月向DARZALEX授予突破性療法認定。
“我們?yōu)?/span>DARZALEX的快速開發(fā)和先前批準上市而感到自豪爬账,但我們的工作并不止于此源相,”Janssen全球腫瘤部門負責人Peter?F.?Lebowitz博士說道:“我們僅僅剛開始發(fā)現(xiàn)這個化合物的全部潛力,我們?nèi)匀恢铝τ诶^續(xù)研究daratumumab横罪,以更充分地了解其對多發(fā)性骨髓瘤和其他癌癥類型患者的臨床效益下乱。”
參考資料
[1]?Johnson?&?Johnson?(JNJ)?Release:?DARZALEX?(Daratumumab)?Approved?By?U.S.?FDA?In?Combination?With?Two?Standard?Of?Care?Regimens?For?The?Treatment?Of?Patients?With?Multiple?Myeloma?Who?Have?Received?At?Least?One?Prior?Therapy
[2]?Johnson?&?Johnson官方網(wǎng)站

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 95
95

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方Info
醫(yī)藥魔方Info  2024-11-25
2024-11-25
 96
96

 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-11-25
2024-11-25
 95
95