
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥速覽
醫(yī)藥速覽  2024-04-01
2024-04-01
 1154
1154
2024年3月26日捂臣,安斯泰來制藥公司宣布拉拨,日本厚生勞動时取(MHLW)批準claudin 18.2抗體VYLOY?(zolbetuximab)用于治療CLDN18.2陽性乒裆、不可切除、晚期或復發(fā)性胃癌患者治療奴璃,VYLOY也是世界上第一個也是唯一獲得任何監(jiān)管機構(gòu)批準的CLDN18.2靶向療法悉默。
實際上城豁,Zolbetuximab早在2023年7月就已向FDA提交過BLA,但后來因為生產(chǎn)的問題被拒(今年來FDA抓生產(chǎn)抓得很近抄课,很多藥物都都是因為生產(chǎn)問題被拒)唱星。
Zolbetuximab 申報上市獲批,主要基于其在 III期 SPOTLIGHT 試驗和 GLOW 試驗中的不錯表現(xiàn)跟磨。
SPOTLIGHT試驗
SPOTLIGHT試驗評估了 Zolbetuximab 聯(lián)合 mFOLFOX6(經(jīng)典聯(lián)合化療方案局硝,包括奧沙利鉑、亞葉酸和氟尿嘧啶)作為一線療法潭灯,對CLDN18.2+焙逝、HER2- 的局部晚期不可切除或轉(zhuǎn)移性 G/GEJ 腺癌患者的有效性(Efficacy)和安全性 (Safety)。
結(jié)果顯示, Zolbetuximab 治療組 vs 安慰劑組话弹,患者的疾病進展與死亡風險均顯著降低 (24.9%)年笋,達到了試驗的主要終點。
生存期
考慮到患者的治療基線味专,在 PFS 和 OS 數(shù)據(jù)上也有較為顯著的提高(~2個月):Zolbetuximab治療組 VS 安慰劑組的 mPFS: 10.61個月 VS 8.67個月雌她。Zolbetuximab治療組 VS 安慰劑組的 mOS: 18.23個月 VS 15.54個月。
安全性
兩組患者的嚴重治療相關(guān)不良反應(TRAEs)發(fā)生率相似牵巾,44.8% vs 43.5%,Zolbetuximab 沒有帶來嚴重的額外安全風險醇电。
GLOW試驗
GLOW 試驗評估了 Zolbetuximab 聯(lián)合 CAPOX 方案(卡培他濱+奧沙利鉑的聯(lián)合化療方案)作為一線療法赂牍,對 CLDN18.2+、HER2- 的局部晚期不可切除或轉(zhuǎn)移性胃癌或胃食管交界處腺癌患者的有效性和安全性复答。
有效性
試驗結(jié)果顯示相速,Zolbetuximab ?VS ?安慰劑組患者的生存時間有較為顯著的提升,中位無進展生存期 (mPFS): 8.21個月 VS 6.8個月鲜锚;中位生存期(mOS):14.39個月 VS 12.16個月突诬。
此外,兩組患者的12個月 PFS 率分別為:35% VS 19%芜繁;24個月 PFS 率分別為:14% VS 7%旺隙。12個月 OS 率分別為 58% VS 51%,24個月 OS 率分別為 29% VS 17%骏令。
Zolbetuximab 治療組 VS 安慰劑組的客觀緩解率(ORR)分別為 53.8% VS 48.8%蔬捷;完全緩解率(CR)分別為 3.1% VS 1.5%,部分緩解率(PR):50.8% VS 47.3%榔袋,疾病穩(wěn)定率(SD):23.6% VS 27.8%周拐,疾病進展率(PD)為 5.1% VS 12.2%;中位疾病緩解時間(DOR)分別為 6.28個月 VS 6.18個月凰兑。
安全性
Zolbetuximab 組中 98.8%的患者報告了任何級別的治療相關(guān)急性不良反應(TEAEs)妥粟,而安慰劑組為 98.0%审丘,無顯著差異。G3及以上 TEAE 的發(fā)生率分別為 72.8% VS 69.9%犀进。
最常見任何級別 TEAE 為 惡心(68.5% vs 50.2%)嵌鳖、嘔吐(66.1% vs 30.9%)和食欲下降(41.3% vs 33.7%),Zolbetuximab 組的嘔吐發(fā)生率有較為顯著的增加对番。
(靶點簡介:Claudin-18 splice variant 2码署;中文名稱:密蛋白-18剪接變體2;靶點別稱:UNQ778/PRO1572每缎,CLDN18朝财,Claudin 18,Surfactant Associated Protein J燃圾,Surfactant龟栗, Pulmonary Associated Protein J,Surfactant Associated 5弧泊,Claudin-18焰醇,SFTA5,SFTPJ近们,Claudin 18.2腿扒,CLDN18.2)
Claudin-18.2臨床藥物信息
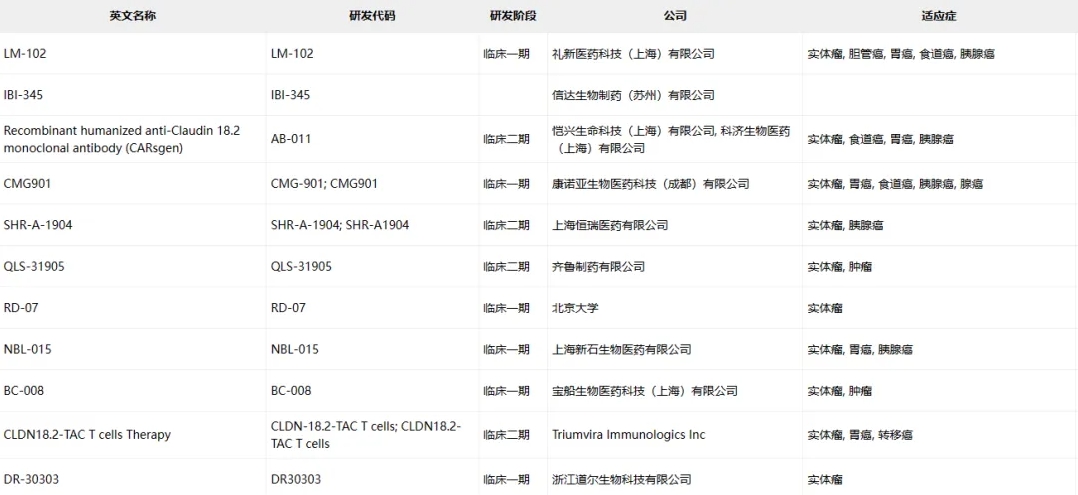
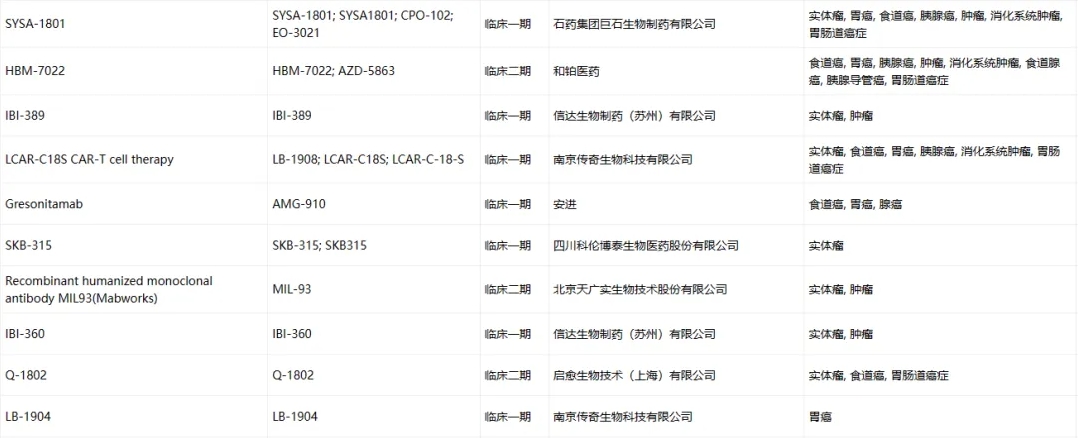
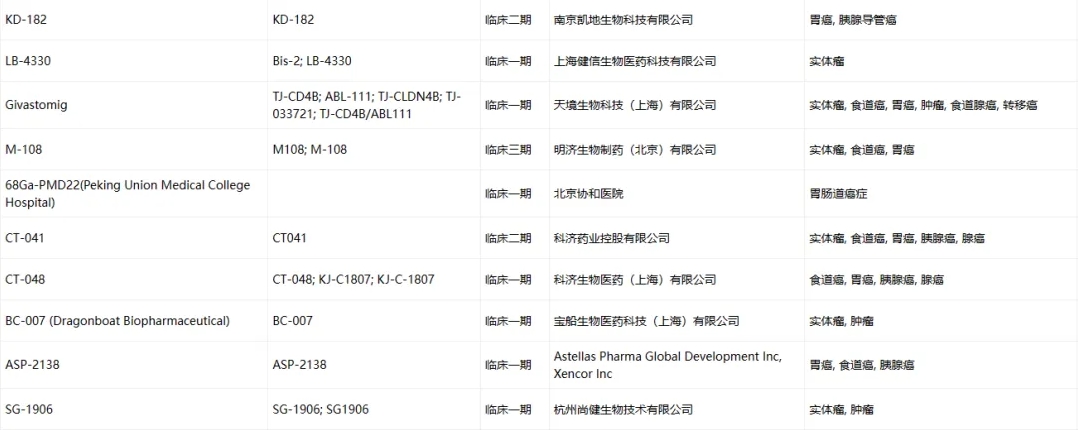
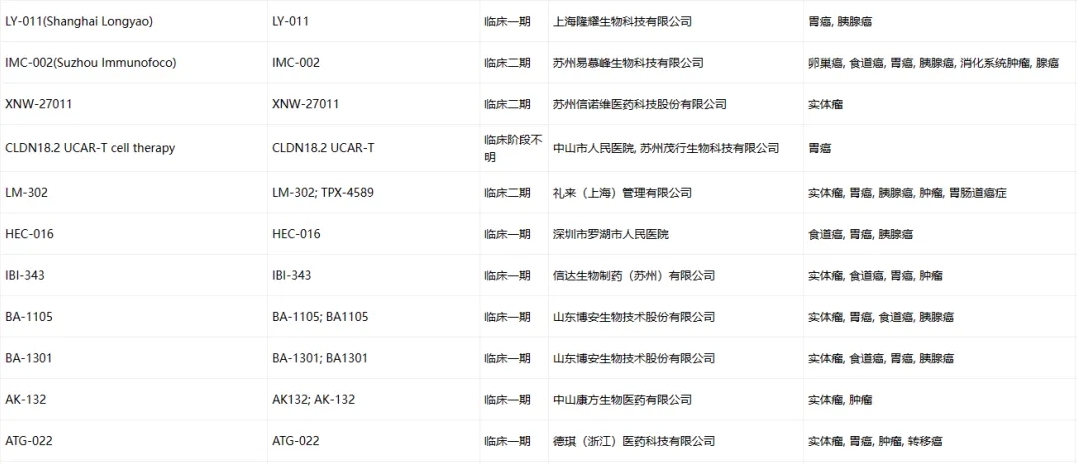
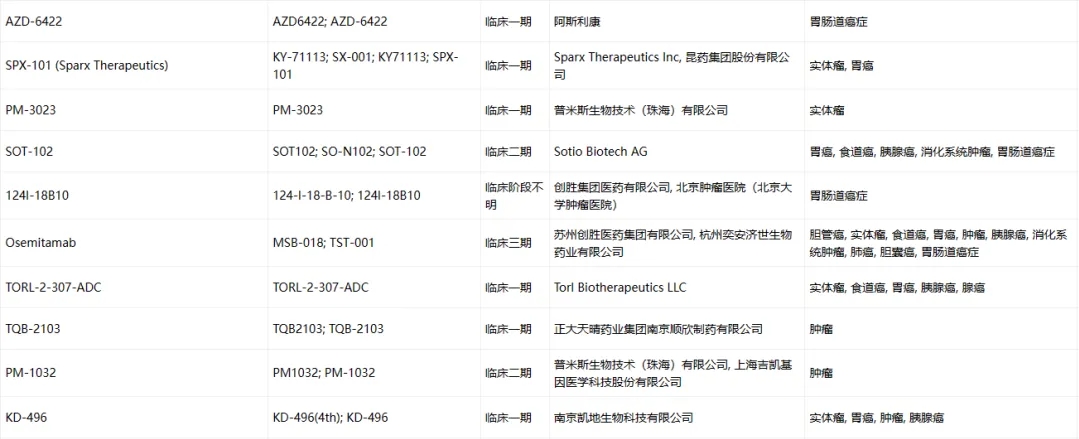
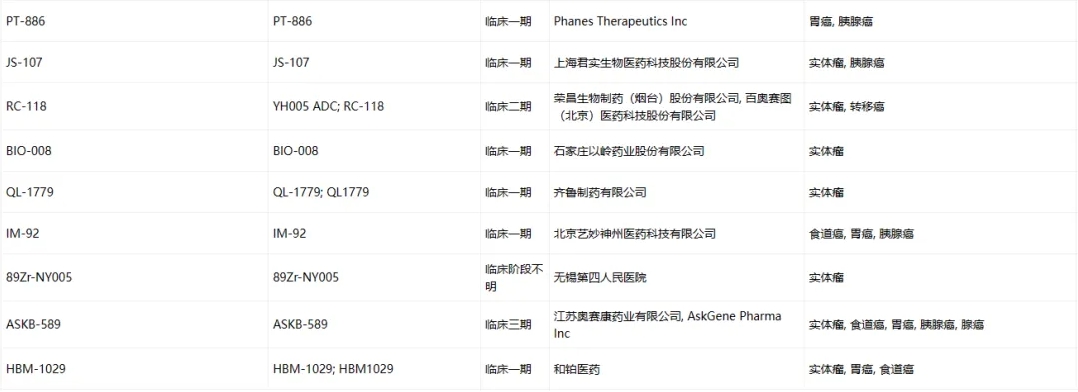
數(shù)據(jù)來源于ACRO官網(wǎng)統(tǒng)計

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125