
 研發(fā)追蹤
研發(fā)追蹤
 雪球
雪球  2024-04-07
2024-04-07
 1254
1254
今日,美國(guó)FDA宣布加速批準(zhǔn)由第一三共(Daiichi Sankyo)和阿斯利康(AstraZeneca)聯(lián)合開(kāi)發(fā)的重磅抗體偶聯(lián)藥物(ADC)Enhertu(trastuzumab deruxtecan)用于治療不可切除或轉(zhuǎn)移性HER2陽(yáng)性(免疫組化[IHC] 3+)實(shí)體瘤成年患者,這些患者已接受過(guò)先前治療且缺乏滿意的替代治療選項(xiàng)。之前新聞稿指出版幕,Enhertu是首款具有不限癌種適應(yīng)癥的HER2靶向ADC療法。值得注意的是,這項(xiàng)批準(zhǔn)對(duì)于罹患HER2陽(yáng)性罕見(jiàn)癌癥的患者尤為重要寸癌,因?yàn)閷iT(mén)針對(duì)這些患者進(jìn)行臨床試驗(yàn)的機(jī)會(huì)較為有限。
這次批準(zhǔn)主要基于在192名經(jīng)治弱贼、不可切除或轉(zhuǎn)移性HER2陽(yáng)性(IHC 3+)實(shí)體瘤成人患者中的療效評(píng)估結(jié)果兰捣,這些患者參加以下三項(xiàng)多中心試驗(yàn)之一:DESTINY-PanTumor02槐骂、DESTINY-Lung01和DESTINY-CRC02。所有三項(xiàng)試驗(yàn)皆排除有間質(zhì)性肺苍尥觥(ILD)或需要類固醇治療肺炎病史的患者肪躯,或著在篩選時(shí)患有ILD、肺炎或臨床上顯著心臟疾病的患者生纫。試驗(yàn)還排除了具有活動(dòng)性腦轉(zhuǎn)移或ECOG體能狀態(tài)>1的患者掀舷。入組患者持續(xù)接受治療,直至病情進(jìn)展都陵、死亡幅猖、撤回同意或出現(xiàn)不可接受的毒性。
三項(xiàng)試驗(yàn)的主要療效結(jié)果指標(biāo)是確認(rèn)客觀緩解率(ORR)造轴,另一個(gè)療效指標(biāo)是緩解持續(xù)時(shí)間(DOR)梢翼。所有結(jié)果均由獨(dú)立中央審評(píng)(ICR)基于RECIST v1.1標(biāo)準(zhǔn)進(jìn)行評(píng)估。在DESTINY-PanTumor02中胀邀,患者的ORR為51.4%(95% CI:41.7雪怠,61.0),中位DOR為19.4個(gè)月(范圍1.3棍鳖,27.9+)炮叶。在DESTINY-Lung01中,ORR為52.9%(95% CI:27.8渡处,77.0)镜悉,中位DOR為6.9個(gè)月(范圍4.0,11.7+)医瘫。在DESTINY-CRC02中侣肄,ORR為46.9%(95% CI:34.3,59.8)醇份,DOR為5.5個(gè)月(范圍1.3+稼锅,9.7+)。
試驗(yàn)中最常見(jiàn)的不良反應(yīng)(≥20%)包括:實(shí)驗(yàn)室指標(biāo)異常僚纷,白細(xì)胞計(jì)數(shù)減少矩距、惡心、血紅蛋白減少怖竭、中性粒細(xì)胞計(jì)數(shù)減少锥债、疲勞、淋巴細(xì)胞計(jì)數(shù)減少茁螺、血小板計(jì)數(shù)減少钧鸥、天冬氨酸氨基轉(zhuǎn)移酶升高、丙氨酸氨基轉(zhuǎn)移酶升高、血液堿性磷酸酶升高膏莽、嘔吐嘱疑、食欲下降、脫發(fā)体六、腹瀉仁灶、血鉀降低、便秘莫诺、鈉降低伐种、口腔炎和上呼吸道感染。
Enhertu是阿斯利康和第一三共聯(lián)合開(kāi)發(fā)的ADC療法畸玲。它采用第一三共專有的DXd ADC技術(shù)平臺(tái)設(shè)計(jì)啡罗,由靶向HER2的人源化單克隆抗體通過(guò)四肽可裂解連接子,與拓?fù)洚悩?gòu)酶1抑制劑有效載荷連接組成揭胶。此前骤视,它已經(jīng)獲得美國(guó)FDA授予的突破性療法認(rèn)定,用于治療轉(zhuǎn)移性HER2陽(yáng)性實(shí)體瘤鹃觉。Enhertu在2019年首次獲美國(guó)FDA批準(zhǔn)专酗,用以治療無(wú)法切除或轉(zhuǎn)移性HER2陽(yáng)性乳腺癌患者。
除了共同開(kāi)發(fā)Enhertu盗扇,阿斯利康和第一三共也共同開(kāi)發(fā)Trop2靶向ADC datopotamab deruxtecan(Dato-DXd)祷肯。美國(guó)FDA在這個(gè)月接受兩家公司所遞交該療法的生物制品許可申請(qǐng),用于治療無(wú)法切除或轉(zhuǎn)移性HR陽(yáng)性疗隶、HER2陰性乳腺癌成人患者佑笋,這些患者已接受過(guò)前期全身治療。
除了與阿斯利康進(jìn)行合作以外斑鼻,第一三共也在去年10月與默沙東(MSD)就該公司的三個(gè)ADC候選藥物:patritumab deruxtecan(HER3-DXd)蒋纬、ifinatamab deruxtecan(I-DXd)和raludotatug deruxtecan(R-DXd)達(dá)成了全球開(kāi)發(fā)和商業(yè)化協(xié)議,將在全球范圍內(nèi)共同開(kāi)發(fā)和潛在商業(yè)化這些候選ADC療法坚弱。
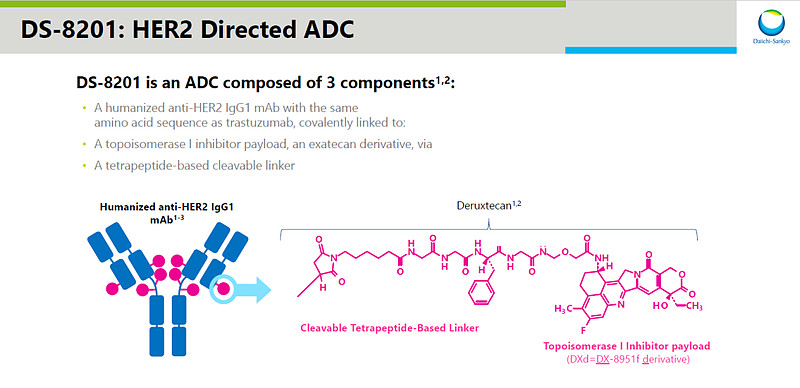
▲Enhertu(DS-8201)結(jié)構(gòu)示意圖(圖片來(lái)源:參考資料[2])
ADC是新藥開(kāi)發(fā)的熱點(diǎn)領(lǐng)域之一蜀备,近年多家大藥企通過(guò)并購(gòu)或授權(quán)協(xié)議在這一領(lǐng)域加碼布局。去年3月荒叶,輝瑞(Pfizer)以430億美元收購(gòu)了ADC先驅(qū)公司Seagen以擴(kuò)展其腫瘤學(xué)管線晾晕。去年12月,艾伯維(AbbVie)以總額達(dá)約101億美元收購(gòu)ImmunoGen钻字,獲得其“first-in-class”抗體偶聯(lián)藥物Elahere(mirvetuximab soravtansine)窃等。今年1月,強(qiáng)生(Johnson & Johnson)斥資高達(dá)約20億美元收購(gòu)Ambrx Biopharma施俩,囊獲其分別靶向前列腺特異性膜抗原(PSMA)與HER2的抗體偶聯(lián)藥物ARX517與ARX788。宜聯(lián)生物(MediLink Therapeutics)也在同月宣布與羅氏(Roche)達(dá)成全球合作和許可協(xié)議每此,將合作開(kāi)發(fā)靶向間質(zhì)表皮轉(zhuǎn)化因子(c-MET)的下一代ADC候選產(chǎn)品YL211(c-MET ADC)披蛔,用于治療實(shí)體瘤截纹。
此外,在研ADC的開(kāi)發(fā)也呈爆發(fā)式增長(zhǎng)趨勢(shì)幻役。根據(jù)摩根士丹利(Morgan Stanley)公司去年發(fā)布的一項(xiàng)報(bào)告贬屹,目前至少有1400項(xiàng)ADC的臨床試驗(yàn)正在進(jìn)行中

 研發(fā)追蹤
研發(fā)追蹤
 藥時(shí)代
藥時(shí)代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽