
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-04-07
2024-04-07
 1265
1265
4月5日感戴,傳奇生物/強生聯(lián)合宣布却怪,美國FDA已批準Carvykti(西達基奧侖賽,cilta-cel)用于治療復(fù)發(fā)或難治性多發(fā)性骨髓瘤(R/R MM)患者,這些患者既往至少接受過一線治療参淹,包括一種蛋白酶體抑制劑(PI)和一種免疫調(diào)節(jié)劑(IMiD)且對來那度胺耐藥。Carvykti是首個且唯一獲批用于多發(fā)性骨髓瘤患者二線治療的B細胞成熟抗原 (BCMA) 靶向療法,包括CAR-T療法、雙特異性抗體和抗體藥物偶聯(lián)物(ADC)斧吐。

FDA的批準是基于CARTITUDE-4研究的積極結(jié)果,該研究評估了Carvykti與泊馬度胺仲器、硼替佐米和地塞米松(PVd)或達雷妥尤單抗煤率、泊馬度胺和地塞米松(DPd)對比,在既往接受過1-3線治療后復(fù)發(fā)且來那度胺耐藥的多發(fā)性骨髓瘤患者中的療效和安全性乏冀。既往接受1-3線治療且來那度胺難治的R/R MM患者隨機接受cilta-cel(n=208)或醫(yī)生選擇方案(n=211)蝶糯。
結(jié)果顯示,cilta-cel組mPFS顯著改善(NR vs 11.8個月煤辨,HR=0.41裳涛,95%CI 0.30-0.56,p<0.0001)侥锨,達到主要終點;關(guān)鍵次要終點ORR同樣顯示獲益(85% vs 68%扑跌,p<0.0001)扇殃,不過FDA注意到cilta-cel組死亡導(dǎo)致的PFS事件比例更高(8% vs 2%)。
目前创皿,中期OS數(shù)據(jù)尚不成熟(34% information fraction)投戴,兩組中位OS分別為未達到和26.7個月(HR 0.78,95%CI 0.51-1.20)爸蝠。兩組的OS Kaplan-Meier曲線在~11個月時交叉梢跳,即前~11個月中cilta-cel組具有更低的OS。安全性方面十旗,cilta-cel與既往報道結(jié)果基本一致仲峡。
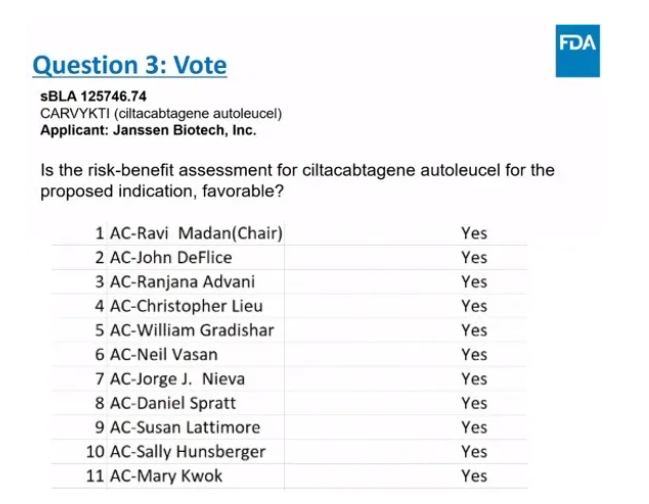
今年3月15日,F(xiàn)DA ODAC(腫瘤藥物咨詢委員會)會議中專家組以11票贊同溯内,0票反對的結(jié)果酵逾,認為Carvykti用于既往至少接受過1線治療(包括PI和IMiD且來那度胺難治)的R/R MM成人患者具有有利的獲益-風(fēng)險結(jié)果。
傳奇生物首席執(zhí)行官黃穎博士表示:“Carvykti適應(yīng)癥的擴大有望改變多發(fā)性骨髓瘤的治療格局,為醫(yī)生和患者提供了一種可在早期治療方案中使用的個性化免疫療法尝盼。多發(fā)性骨髓瘤是一種無法治愈且不斷進展的血液腫瘤吞滞,會導(dǎo)致患者復(fù)發(fā)并產(chǎn)生耐藥,因此亟需創(chuàng)新的治療選擇盾沫。我們致力于改善血液腫瘤患者的生活質(zhì)量裁赠,并持續(xù)努力開發(fā)出能夠為患者帶來治愈希望的細胞療法「熬“

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125