
 研發(fā)追蹤
研發(fā)追蹤
 動脈新醫(yī)藥
動脈新醫(yī)藥  2024-04-22
2024-04-22
 1410
1410
4月15日搭肠,羅氏宣布啼器,CD3/CD20雙抗格菲妥單抗(商品名:Columvi)用于復發(fā)或難治性彌漫性大B細胞淋巴瘤(DLBCL)的Ⅲ期STARGLO研究達到了總生存期這一主要終點遏谭,與利妥昔單抗聯(lián)合奧沙利鉑治療組相比趴酣,接受格菲妥單抗聯(lián)合吉西他濱以及奧沙利鉑治療的患者總生存期具有統(tǒng)計學意義的改善伺罗。
本次公布的Ⅲ期STARGLO研究是一項隨機频鉴、多中心榄檬、開放標簽的臨床試驗桃犬,旨在評估格菲妥單抗聯(lián)合吉西他濱+奧沙利鉑與利妥昔單抗+奧沙利鉑相比刹悴,用于既往已接受過至少一種治療且不適合自體干細胞移植的DLBCL患者的療效和安全性。
此次研究的終點指標包括總生存期(OS攒暇,主要終點)土匀,無進展生存期(PFS)、完全緩解率(CR)形用、客觀緩解率(ORR)就轧、客觀緩解持續(xù)時間等次要終點,以及安全性和耐受性尾序。研究結(jié)果顯示钓丰,格菲妥單抗聯(lián)合治療組能夠顯著改善患者OS,此外其安全性與單個藥物已知安全性一致每币。羅氏將在之后的醫(yī)學會議中報道這一研究數(shù)據(jù)携丁。
格菲妥單抗
有何特別之處?
根據(jù)羅氏公開資料峰遇,格菲妥單抗是一款靶向CD20和CD3的雙特異性T細胞銜接蛋白拿详。它具有獨特的2:1結(jié)構(gòu),包含兩個可以與CD20結(jié)合的蛋白域和一個可以與CD3結(jié)合的蛋白域篡前。此雙重靶向策略可使T細胞靠近B細胞户克,并活化T細胞以釋放癌細胞毒殺蛋白,同時它與已經(jīng)獲批的抗CD20單克隆抗體聯(lián)用時可以獲得更好的效果泡愉。
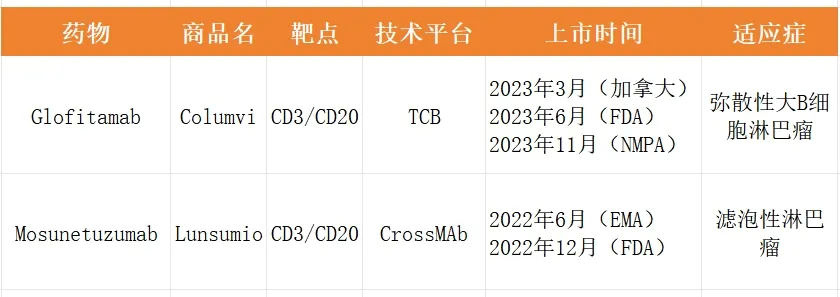
Columvi也是首個獲得美國FDA加速批準和歐盟委員會有條件上市的固定時間治療的雙特異性抗體输僻,用于治療接受過兩線或兩線以上全身治療的R/R DLBCL患者。該批準是基于Columvi作為單藥在關(guān)鍵1/2期研究NP30179中所取得的積極結(jié)果锄灾。
2023年3月25日春庇,格菲妥單抗在加拿大拿到全球首批。2023年6月16日又在美國取得監(jiān)管批準。2023年11月8日猜逮,格菲妥單抗獲得藥監(jiān)局批準上市胆快,用于治療既往接受過至少兩線系統(tǒng)性治療的復發(fā)或難治性彌漫大B細胞淋巴瘤成人患者。作為全球首個對R/R DLBCL患者進行固定周期治療的雙抗照菱,格菲妥單抗在國內(nèi)的獲批也標志著中國淋巴瘤治療進入雙抗時代烁焙。
Glofitamab是繼Mosunetuzumab之后,羅氏成功開發(fā)的第二款CD3/CD20雙抗耕赘,也是羅氏T細胞接合器雙特異性抗體產(chǎn)品組合的又一大突破骄蝇。
兩款藥物都在治療淋巴瘤方面取得顯著成果,雖都能夠增強T細胞對惡性B細胞的殺傷作用鞠苟,但它們在分子結(jié)構(gòu)乞榨、作用強度、主攻瘤種和應(yīng)用場景等方面存在差異当娱,因此可以相互補充吃既,覆蓋更廣泛的淋巴瘤患者群體。
在結(jié)構(gòu)設(shè)計方面跨细,Glofitamab采用2:1型非對稱雙特異抗體的結(jié)構(gòu)鹦倚,其中兩個Fab可以與腫瘤細胞表面的CD20結(jié)合,另外一個Fab與T細胞表面的CD3抗原結(jié)合冀惭,從而增強抗體與腫瘤細胞表面抗原的結(jié)合震叙。mosunetuzumab則采用1:1型、IgG1樣雙特異性抗體結(jié)構(gòu)散休,其中一個Fab與腫瘤細胞表面的CD20結(jié)合媒楼,另外一個Fab與T細胞表面的CD3抗原結(jié)合。
由于2:1形式的抗體具有有更強的殺傷效果促讶,因此glofitamab的作用強度更強观哲,可以在安全耐受的前提條件下加強殺傷腫瘤細胞的能力,對侵襲性和難治淋巴瘤行之有效侮捷。而mosunetuzumab的療效則相對溫和担戏,細胞因子釋放綜合征(CRS)發(fā)生概率相對較低,更適用于治療濾泡性淋巴瘤(FL)等惰性淋巴瘤偶画。
由于glofitamab作用強度較大堵生,細胞因子釋放綜合征(CRS)發(fā)生概率相對較高(70%左右),需要在治療期間監(jiān)測患者的安全性祟期,因此需要住院治療钾士。而mosunetuzumab的 CRS發(fā)生率較低(39%左右),且大部分為低級別希弟。因此mosunetuzumab用藥場景會更為靈活拙达,適用于門診和社區(qū)醫(yī)院環(huán)境得稼,更符合中國患者的實際情況腐蛀。
這兩款藥物事實上是羅氏根據(jù)不同的臨床場景俭驮,通過不同的技術(shù)平臺深植于分子設(shè)計,以互補的形式觸及現(xiàn)實中更多的治療場景春贸,實現(xiàn)了更廣泛的淋巴瘤患者群體覆蓋混萝。
CD20/CD3雙抗之戰(zhàn)
在2018年的ASH大會上,5款CD20/CD3雙抗亮相萍恕,展現(xiàn)了比肩CAR-T療法的臨床療效逸嘀,令CD20/CD3雙抗很快成為國內(nèi)外制藥巨頭布局血液腫瘤雙抗的一大重點方向。
目前FDA共批準3款CD20×CD3 TCE上市允粤,2款來自羅氏崭倘,1款來自艾伯維,全部為加速批準上市类垫,用于治療FL和DLBCL司光。加上排隊中的CD20/CD3藥物,將迎來一波激烈的市場競爭悉患。
羅氏是第一個將CD20/CD3雙抗藥物推向市場的公司残家。2022年6月,羅氏的第一款CD20/CD3雙抗Mosunetuzumab(商品名Lunsumio)獲得了歐盟委員會有條件上市批準(3線+復發(fā)性/難治性濾泡性淋巴瘤)售躁,成為全球首個獲批上市CD20/CD3雙抗闸骨。之后,Genmab/艾伯維的Epcoritamab缰鹏、羅氏的第二款CD20/CD3雙抗Glofitamab陸續(xù)獲得批準上市奔祟。
Genmab/艾伯維的Epkinly與羅氏的兩款CD20/CD3雙抗最主要的區(qū)別在于給藥方式,前者為皮下注射榄路,具有更好的臨床便利優(yōu)勢翎丢。不過,羅氏同樣在開發(fā)Lunsumio的皮下制劑蔼于。
利妥昔單抗的推出為羅氏打開了淋巴瘤治療市場的大門即荞,同時也為羅氏在淋巴瘤治療領(lǐng)域的研究和開發(fā)奠定了堅實的基礎(chǔ)。在此基礎(chǔ)上柴怒,羅氏開發(fā)的兩款CD3/CD20雙抗則是為了滿足治療淋巴瘤的不同需求和臨床場景尾疟,可以相互補充,從而覆蓋更廣泛的淋巴瘤患者群體肩雾。
國內(nèi)布局者亦不少垫弱,嘉和生物、正大天晴症杏、君實生物等CD20/CD3雙抗都處在臨床階段装获。在日益白熱化的CD20/CD3賽道上瑞信,后來者要對已上市的競品構(gòu)成實質(zhì)性挑戰(zhàn),面臨差異化競爭門檻更高穴豫。
英文鏈接:https://www.roche.com/media/releases/med-cor-2024-04-15

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125