
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥地理
醫(yī)藥地理  2024-05-10
2024-05-10
 322
322
紐約時(shí)間5月6日憾擒,生物技術(shù)公司Cellectics宣布在獲得法國(guó)經(jīng)濟(jì)部批準(zhǔn)并滿足所有其他交易條件后猪攀,阿斯利康已完成了1.4億美元的額外股權(quán)投資。阿斯利康認(rèn)購(gòu)了1000萬(wàn)股“A類(lèi)”可轉(zhuǎn)換優(yōu)先股和1800萬(wàn)股“B類(lèi)”可轉(zhuǎn)換優(yōu)先股贷腕,每股價(jià)格為5美元背镇。在追加投資完成后,阿斯利康立即擁有了該公司44%的股本和30%的投票權(quán)(基于目前未償還的投票權(quán)數(shù)量)泽裳,作為額外投資的條件之一瞒斩,Marc Dunnoyer和Tyrell Rivers也正式加入Cellectics董事會(huì)。
實(shí)際上,2023年阿斯利康就曾斥資8000萬(wàn)美元購(gòu)買(mǎi)了Cellectics 22%的股份胸囱,該協(xié)議旨在基于Cellectics的基因編輯技術(shù)和生產(chǎn)能力祷舀,為腫瘤學(xué)、免疫學(xué)和罕見(jiàn)病設(shè)計(jì)細(xì)胞和基因療法烹笔。根據(jù)協(xié)議裳扯,阿斯利康預(yù)付了2500萬(wàn)美元,并有權(quán)選擇在IND提交前谤职,根據(jù)研究合作協(xié)議開(kāi)發(fā)的任何候選藥物行使獨(dú)家許可權(quán)嚎朽。
Cellectics是一家臨床階段的生物技術(shù)公司,利用其開(kāi)創(chuàng)性的基因編輯平臺(tái)開(kāi)發(fā)細(xì)胞和基因療法柬帕,該公司開(kāi)創(chuàng)了腫瘤學(xué)中的CAR-T免疫治療以及在各種疾病的造血干細(xì)胞中進(jìn)行治療性基因編輯的平臺(tái)。作為一家擁有24年經(jīng)驗(yàn)的基因編輯公司诫瑞,Cellectics正利用其基因編輯技術(shù)TALEN和開(kāi)創(chuàng)性的電穿孔系統(tǒng)PulseAgile開(kāi)發(fā)可以改變?nèi)祟?lèi)生活的后補(bǔ)產(chǎn)品秃囚,使免疫系統(tǒng)自發(fā)治療不能被臨床治愈的疾病。
從產(chǎn)品線上看喘玄,Cellectics目前自主擁有3個(gè)產(chǎn)品测佣,分別是UCART22、UCART123蝗悼、UCART20×22忽件。除此之外,Cellectics還將CEMACABTAGENE ANSEGEDLEUCEL出募、ALLO-715涌俘、ALLO-605、ALLO-316授權(quán)給了其他企業(yè)蒂扇,足以證明該公司出色的研發(fā)能力昔永。

圖1 ?Cellectics產(chǎn)品線
Cellectics的自研產(chǎn)品中取得了不錯(cuò)的臨床實(shí)驗(yàn)結(jié)果,以針對(duì)UCART22的BALLI-01實(shí)驗(yàn)為例喝暂,該藥針對(duì)CD22靶點(diǎn)缺钓,適應(yīng)癥為急性淋巴細(xì)胞白血病。在臨床效果方面叫胁,使用FCA淋巴細(xì)胞清除術(shù)后凰慈,患者的淋巴細(xì)胞仍然受到了抑制,大約七分之二的DL2/DL2i患者在第28天使用FCA淋巴細(xì)胞清除術(shù)使原細(xì)胞減少到<5%驼鹅。并且在DL3(3/6例)伴有FCA淋巴細(xì)胞缺失的患者中觀察到了50%的ORR微谓。

圖2 ?UCART22-P1和FCA淋巴細(xì)胞耗竭治療的臨床效果
在安全性方面,選取17至61歲的患者入組谤民,共計(jì)19人堰酿,平均年齡為28歲,按照WHO提供的疾病分類(lèi),患有B-ALL伴復(fù)發(fā)性遺傳異常的患者有8人(占比42%)触创、CRFL2重排的患者有4人(占比21%)坎藐。在這些患者中,既往接受過(guò) blinatumomab治療的有12人(占比63%)哼绑、既往接受過(guò) inotuzumab治療的有10人(占比53%)岩馍、既往接受過(guò) CD19 CART治療的有8人(占比42%)、既往接受過(guò)HSCT治療的有8人(占比42%)抖韩。在經(jīng)過(guò)相關(guān)治療后浇沧,未出現(xiàn)劑量限制毒性、免疫效應(yīng)細(xì)胞相關(guān)神經(jīng)毒性豹炊、與UCART22相關(guān)的治療緊急事件坏扣、3級(jí)以上的CRS。有1名患者的皮膚上出現(xiàn)了二級(jí)GvHD遂报,有11名患者出現(xiàn)了1到2級(jí)的CRS癥狀则徒。由于樣本較少,該藥的安全性仍需持續(xù)監(jiān)測(cè)瞳弱,目前未發(fā)生危及生命的不良反應(yīng)冠幕。

圖3 ?UCART22-P1耐受安全性
根據(jù)PDB藥物綜合數(shù)據(jù)庫(kù)數(shù)據(jù)顯示,2017年纽债,針對(duì)CD22靶點(diǎn)的奧加伊妥珠單抗上市雇蚁;2019年,帕西妥歐單抗也成功上市倚痰,但市場(chǎng)占有率遠(yuǎn)低于奧加伊妥珠單抗讥高。2017年,全球CD22靶點(diǎn)上市產(chǎn)品銷(xiāo)售額為3771萬(wàn)美元系谐,2018年增長(zhǎng)至1.37億美元岭埠,同比增長(zhǎng)262.95%;2019年增長(zhǎng)至1.67億美元蔚鸥,同比增長(zhǎng)22.16%惜论。2020年和2021年,該類(lèi)市場(chǎng)銷(xiāo)售額穩(wěn)定在2億美元左右止喷;2022年首次突破2億美元馆类,達(dá)到了2.22億美元,同比增長(zhǎng)13.92%弹谁;2023年前三季度該類(lèi)市場(chǎng)銷(xiāo)售額達(dá)到了1.75億美元乾巧,有望再創(chuàng)新高。
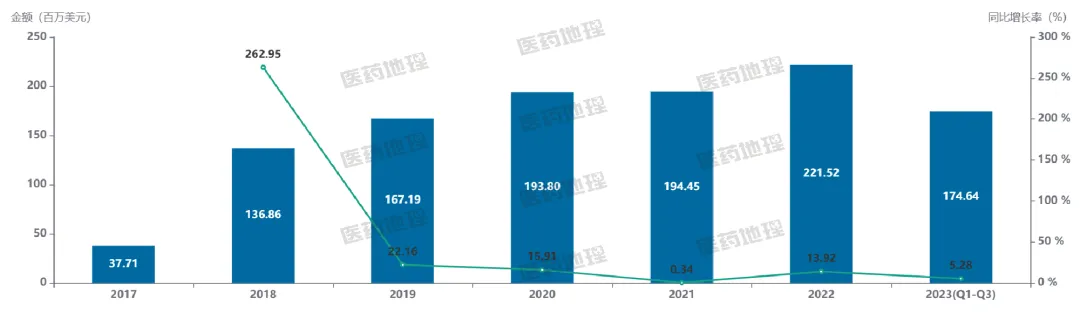
圖4 ?CD22靶點(diǎn)上市產(chǎn)品全球銷(xiāo)售額 來(lái)源:PDB藥物綜合數(shù)據(jù)庫(kù)
目前來(lái)看预愤,新的靶點(diǎn)能夠帶來(lái)新的機(jī)會(huì)沟于。近年來(lái)咳胃,阿斯利康也一直在加大對(duì)細(xì)胞和基因治療的投資,2023年12月旷太,阿斯利康斥資12億美元收購(gòu)了中國(guó)細(xì)胞治療公司亙喜生物展懈,今年初,該公司撥款3億美元在馬里蘭州建立了生產(chǎn)基地祟勿,成效如何停柬,需要留給時(shí)間檢驗(yàn)。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 87
87

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 89
89

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 92
92
 熱門(mén)資訊
熱門(mén)資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽