
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 14
14
羅氏“病急亂投醫(yī)”?
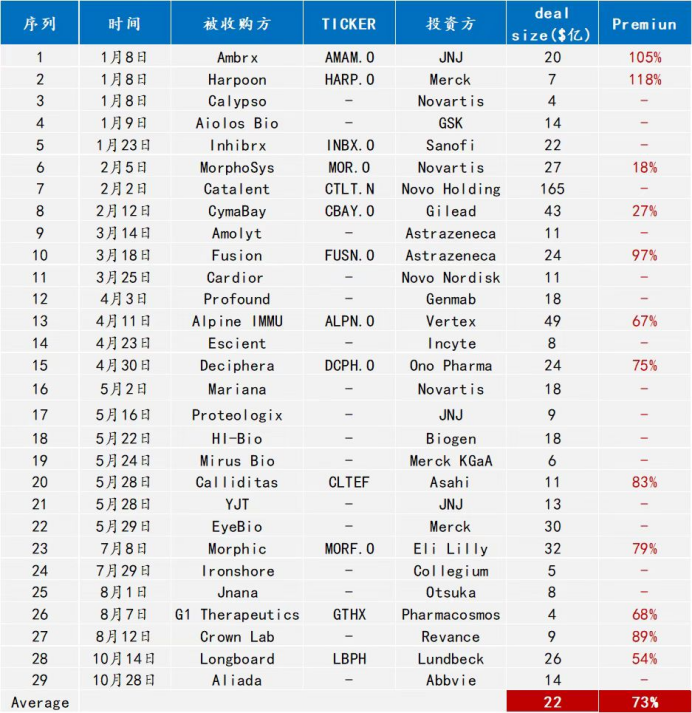
11月26日,羅氏公司以每股9美元現(xiàn)金總價(jià)值股本10億美元收購(gòu)細(xì)胞療法公司Poseida Therapeutics乓记,Poseida股東還將以每股總計(jì)4美元的現(xiàn)金獲得一份不可交易的或有價(jià)值權(quán),交易總價(jià)值高達(dá)約15億美元凯挟。
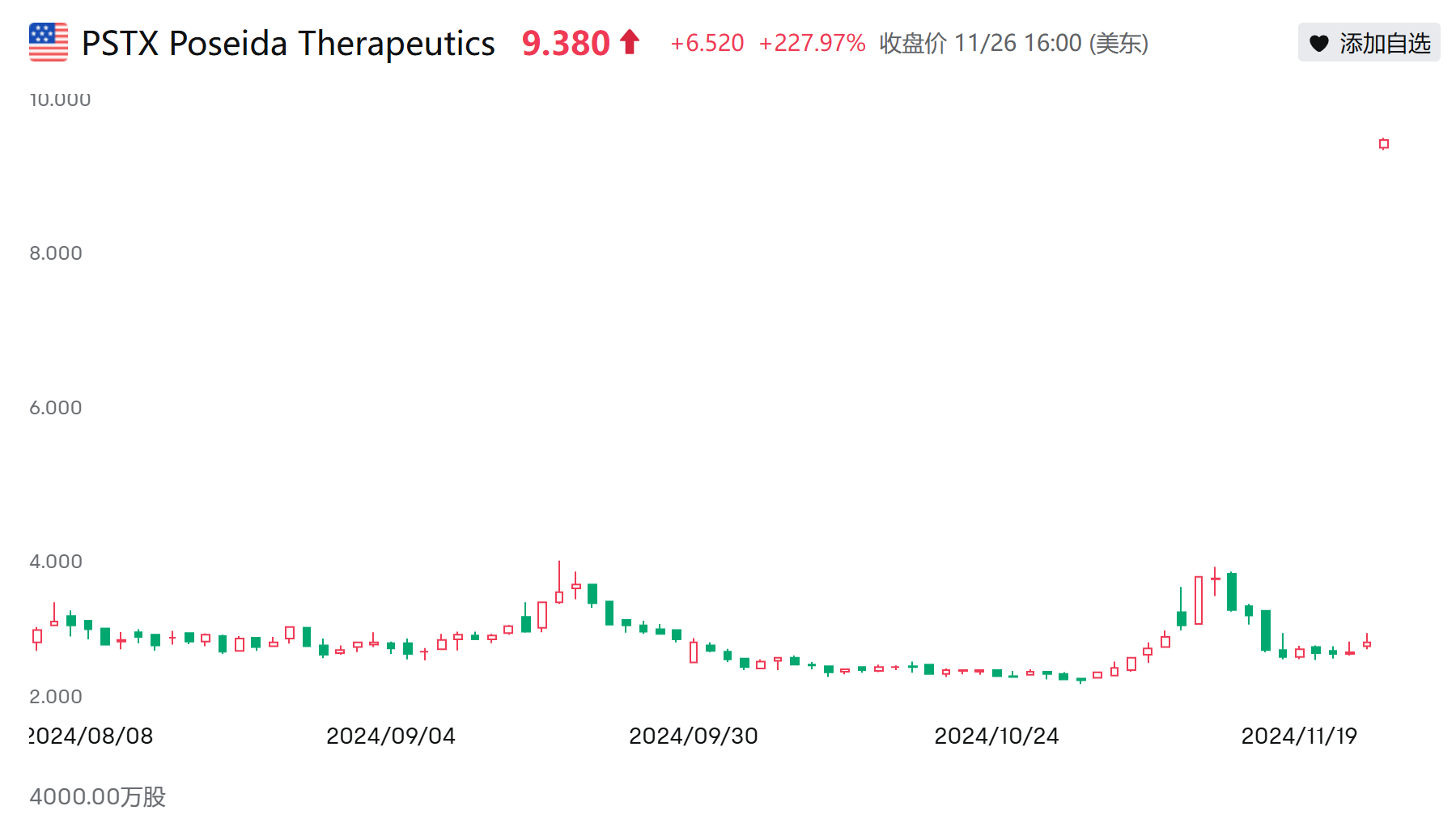
11月25日Poseida的收盤價(jià)僅2.86美元美股逸铆,這次并購(gòu)交易不算CVR,溢價(jià)高達(dá)249.65%辱滤,創(chuàng)下了2024年全球生物醫(yī)藥并購(gòu)案的溢價(jià)之最苦钱。
(圖源:機(jī)車寶貝)
透過(guò)這個(gè)交易,投資者們或許可以更加篤定的往通用型CAR-T領(lǐng)域進(jìn)行投資標(biāo)的的挖掘媳惦,大概率能抓住繼ADC滴图、雙抗之后的BD風(fēng)口,我們不妨先剖析一下這筆重磅交易碎员。
羅氏為啥高溢價(jià)收購(gòu)灸室?
羅氏在腫瘤領(lǐng)域著實(shí)缺少一些新型分子的爆點(diǎn),尤其是在細(xì)胞治療領(lǐng)域倾圣,公司比較缺產(chǎn)品管線鹿鳖,收購(gòu)Poseida算是對(duì)通用型CAR-T的一步落子。
羅氏是全球腫瘤領(lǐng)域的傳統(tǒng)豪強(qiáng)壮莹,但從2024H1公司實(shí)體瘤板塊只有2%增長(zhǎng)和血液瘤板塊錄得10%增長(zhǎng)來(lái)看翅帜,公司正處于產(chǎn)品更新?lián)Q代的變革期。
羅氏“老三駕馬車”貝伐珠單抗命满、利妥昔單抗和曲妥珠單抗都已邁過(guò)專利期涝滴,不斷面臨生物類似藥的份額蠶食;“新三駕馬車”帕妥珠單抗胶台、恩美曲妥珠單抗歼疮、阿替利珠單抗也正在面臨各自的問(wèn)題,如恩美曲妥珠單抗被新一代的ADC擠壓诈唬、阿替利珠單抗面臨雙抗分子的沖擊等韩脏。
從新的管道開(kāi)發(fā)選擇上,羅氏基本上也是“四面出擊”铸磅,雙抗大家都知道公司在MNC中處于第一梯隊(duì)赡矢,誕生了Hemlibra(血友病)阅仔、Vabysmo(眼科)這樣的重磅炸彈洁拓;ADC層面,公司在HER2靶點(diǎn)上占到了先機(jī)開(kāi)發(fā)出恩美曲妥珠單抗秕射,隨后又推出了血液瘤領(lǐng)域Polivy(CD79b ADC )挑蚕,并引進(jìn)了宜聯(lián)生物的c-Met ADC;拋開(kāi)小分子創(chuàng)新藥和復(fù)方制劑創(chuàng)新領(lǐng)域不看匕磅,最熱的新興分子領(lǐng)域,羅氏似乎只剩下CAR-T沒(méi)有布局了陶啥。
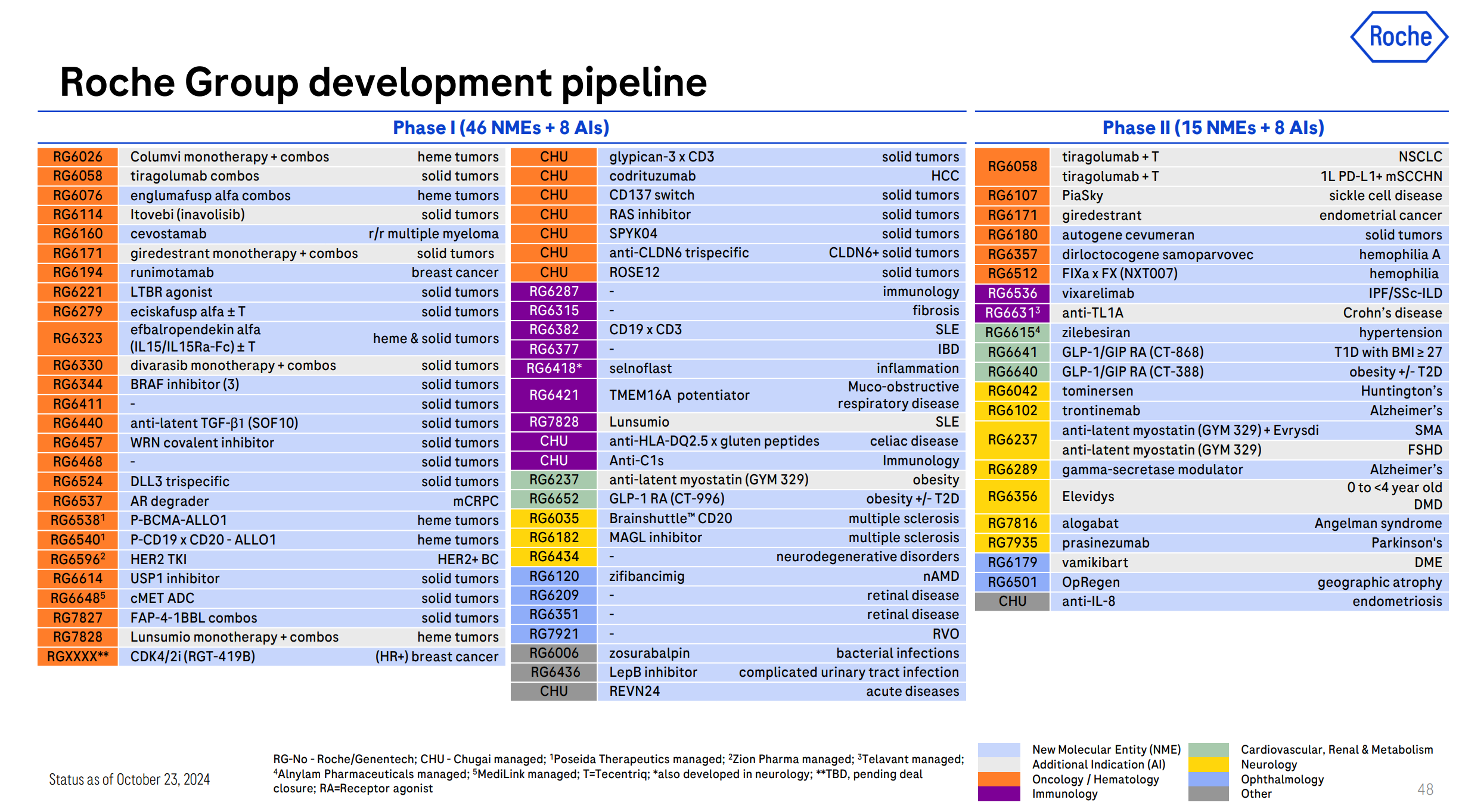
(羅氏2024年二季度PPT)
相比吉利德晃逞、強(qiáng)生箍颗、諾華等手中有CAR-T產(chǎn)品線和生產(chǎn)線的MNC,羅氏不具備優(yōu)勢(shì)虽才,所以必須收購(gòu)一個(gè)有迭代管線(通用型CAR-T)纲愁、技術(shù)平臺(tái)型(可持續(xù)產(chǎn)生新型管線)和具備生產(chǎn)能力&設(shè)施的CAR-T Biotech,顯然Poseida均具備上述所有條件寨都。
當(dāng)然诫汇,羅氏高溢價(jià)收購(gòu)Poseida也不是“病急亂投醫(yī)”,在2022年雙方達(dá)成一項(xiàng)合作昼接,羅氏將擁有Poseida多款血液學(xué)腫瘤的同種異體CAR-T項(xiàng)目選擇權(quán)爽篷,交易總額高達(dá)60億美元,Poseida已經(jīng)拿到了1.1億美元的預(yù)付款和8000萬(wàn)里程碑付款慢睡,當(dāng)時(shí)首發(fā)管線P-BCMA-ALLO1仍處于臨床一期逐工、雙靶點(diǎn)CAR-T療法P-CD19CD20-ALLO1剛剛進(jìn)入臨床。而后續(xù)的收購(gòu)也是P-BCMA-ALLO1讀出一期數(shù)據(jù)之后漂辐,羅氏才出手的泪喊,也算“知根知底”。
為何通用型CAR-T療法逐漸火熱髓涯?除了能夠解決自體CAR-T療法的成本售價(jià)袒啼、安全性問(wèn)題之外,新一代優(yōu)化后的通用型療法在血液瘤纬纪、實(shí)體瘤蚓再、自免等領(lǐng)域擁有更大的施展空間,顯然整體的天花板在不斷往上提育八。
不過(guò)对途,通用型CAR-T目前還有很多問(wèn)題需要解決。
Poseida Therapeutics的平臺(tái)價(jià)值
不得不說(shuō)髓棋,Poseida的確是一家有特點(diǎn)的通用型CAR-T公司锉寿,其技術(shù)路線迥異于其他同種異體CAR-T,同時(shí)兼具平臺(tái)價(jià)值趴国。
Poseida構(gòu)建了一個(gè)差異化的CAR-T技術(shù)平臺(tái)泣虚,由不同的工具方法組成,關(guān)鍵詞包括:干細(xì)胞記憶型T細(xì)胞(TSCM)债苍、非病毒基因插入系統(tǒng)坠痒、Cas-CLOVER基因編輯系統(tǒng)等。
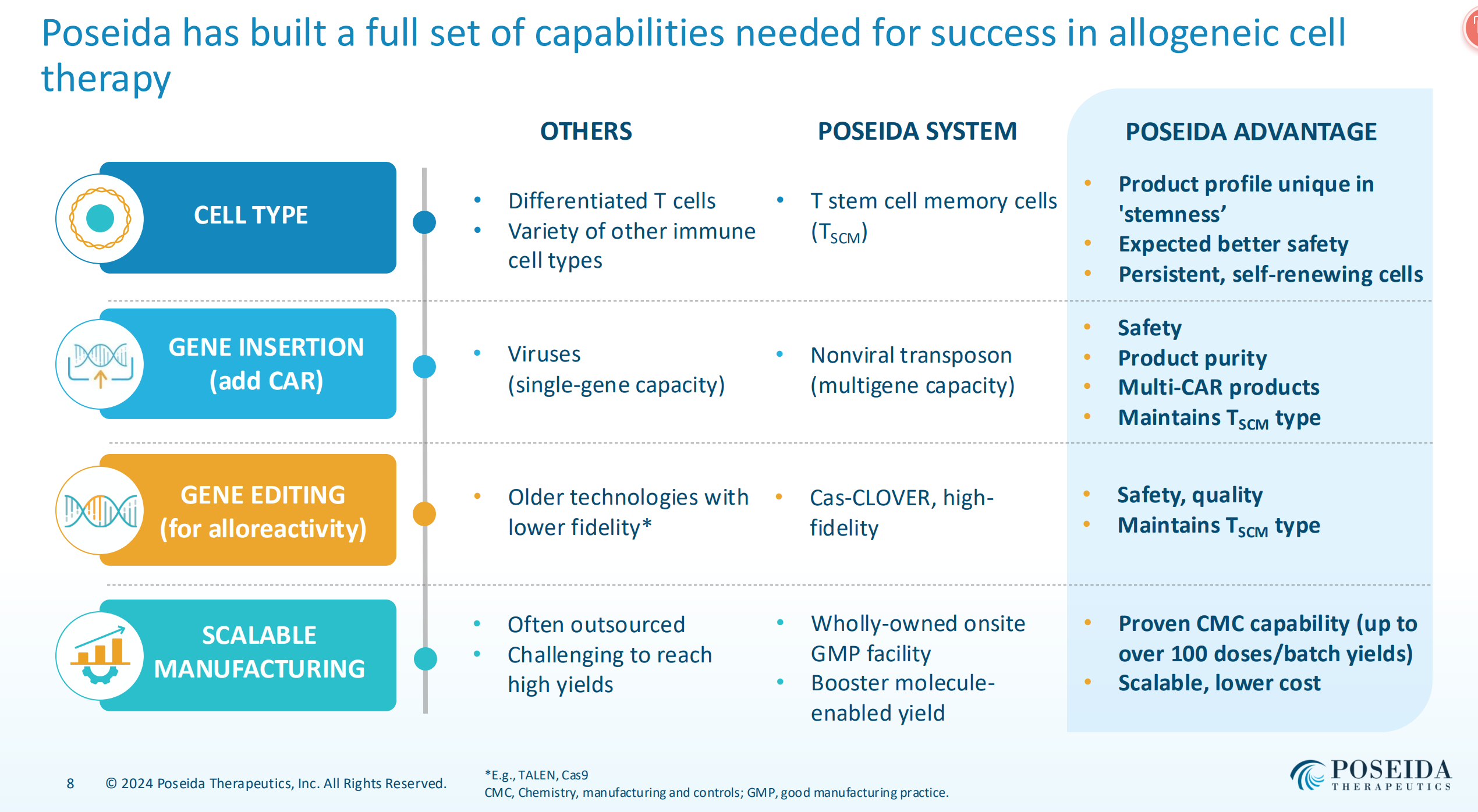
首先從T細(xì)胞的選擇上咳铅,當(dāng)前CAR-T產(chǎn)品的T細(xì)胞主要來(lái)自外周血單個(gè)核細(xì)胞 (PBMC)选阔。而Poseida選擇了T細(xì)胞的一個(gè)特殊亞群干細(xì)胞記憶型T細(xì)胞(TSCM)。TSCM是記憶性T細(xì)胞的祖細(xì)胞具椒,具有超強(qiáng)的自我更新能力坎扰,可分化產(chǎn)生多種記憶性細(xì)胞亞群曹均,重建各類記憶性和效應(yīng)T細(xì)胞,其中一類TSCM亞型半衰期高達(dá)9年物虑。同時(shí)纤悉,有研究表明:體外培養(yǎng)TSCM回輸體內(nèi),可以持續(xù)高效的發(fā)揮T細(xì)胞的抗腫瘤作用鲤遥,并在體內(nèi)保持正常的細(xì)胞活性長(zhǎng)達(dá)12年沐寺。
其次,對(duì)于基因改造解決通用CAR-T帶來(lái)的宿主反應(yīng)和療效持續(xù)時(shí)間問(wèn)題盖奈,Poseida采用了自身特有的Cas-CLOVER基因編輯系統(tǒng)和非病毒基因插入系統(tǒng)工具PiggyBac DNA修飾系統(tǒng)混坞。
目前全球通用CAR-T主流在研企業(yè)大多數(shù)使用基因編輯中的CRISPR技術(shù)進(jìn)行異體T細(xì)胞的改造。Poseida采用的Cas-CLOVER基因編輯系統(tǒng)卜朗,結(jié)合了第一代CRISPR的優(yōu)勢(shì)(易于設(shè)計(jì)拔第、低成本、多功能)和同型二聚體核酸酶系統(tǒng)(如TALEN)的特異性场钉,這是一種易于操作蚊俺、高精確度的基因編輯技術(shù)(據(jù)公司介紹精確度比CRISPR-Cas9高25倍),不僅可編輯靜息的T細(xì)胞逛万,而且在臨床前研究中幾乎沒(méi)有脫靶毒性泳猬。
在導(dǎo)入基因(轉(zhuǎn)導(dǎo)CAR)層面,Poseida擁有專有的PiggyBac DNA修飾系統(tǒng)宇植,區(qū)別于現(xiàn)有CAR-T產(chǎn)品采用病毒載體的路線得封,其運(yùn)載能力更強(qiáng)(多基因,包括觸發(fā)基因颗屏、安全開(kāi)關(guān)和誘餌受體等)奈揩、有效降低病毒載體帶來(lái)的致癌風(fēng)險(xiǎn)、生產(chǎn)更為方便(較病毒方法時(shí)間短卑托、制造成本低)效蝎。
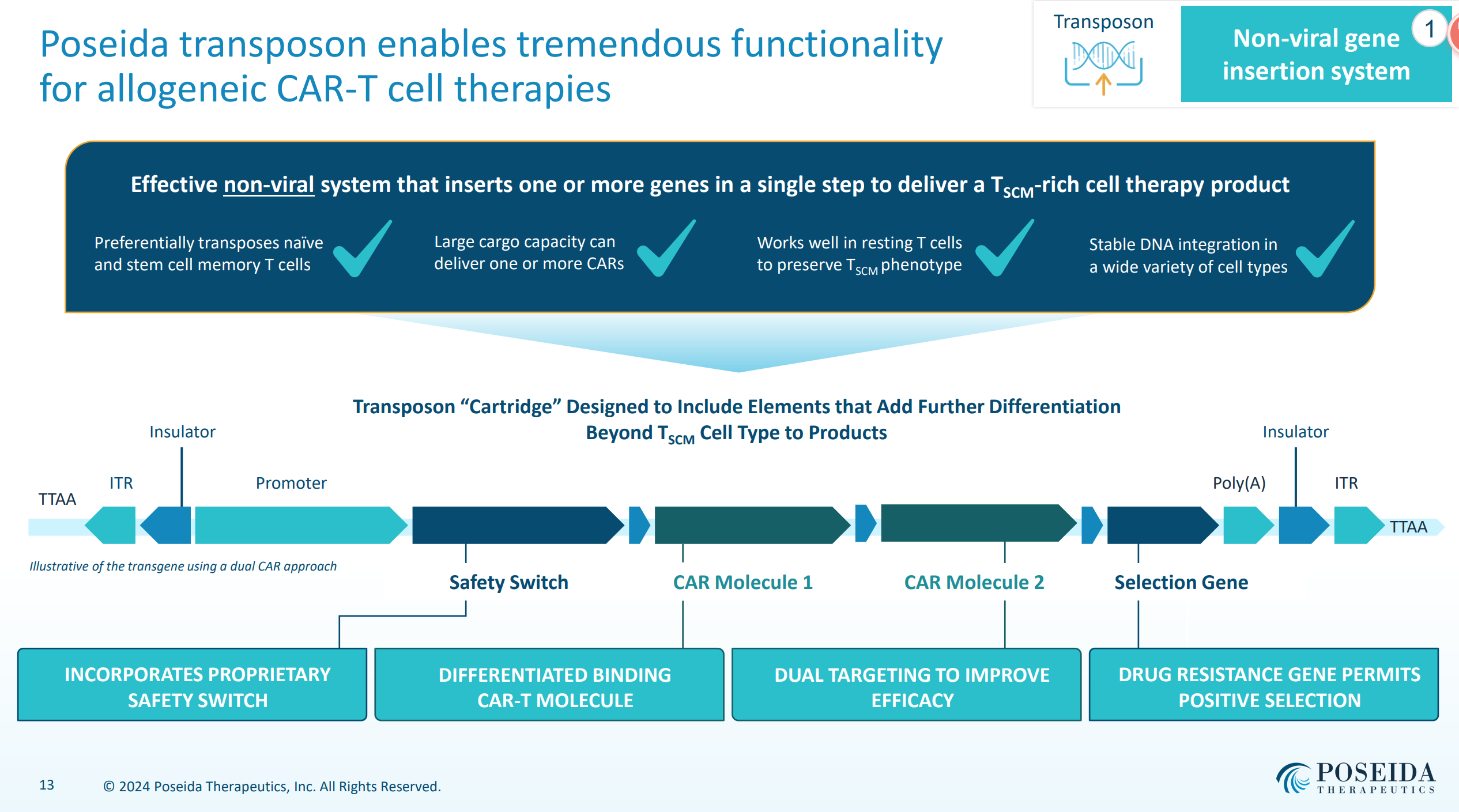
另外值得一提的是Poseida制造平臺(tái),不僅能夠一次生產(chǎn)中生產(chǎn)多達(dá)數(shù)百劑的產(chǎn)品势粱,而且其產(chǎn)品中TSCM純度非常高腰燕,并且Poseida指出該制造平臺(tái)適用于公司所有產(chǎn)品。
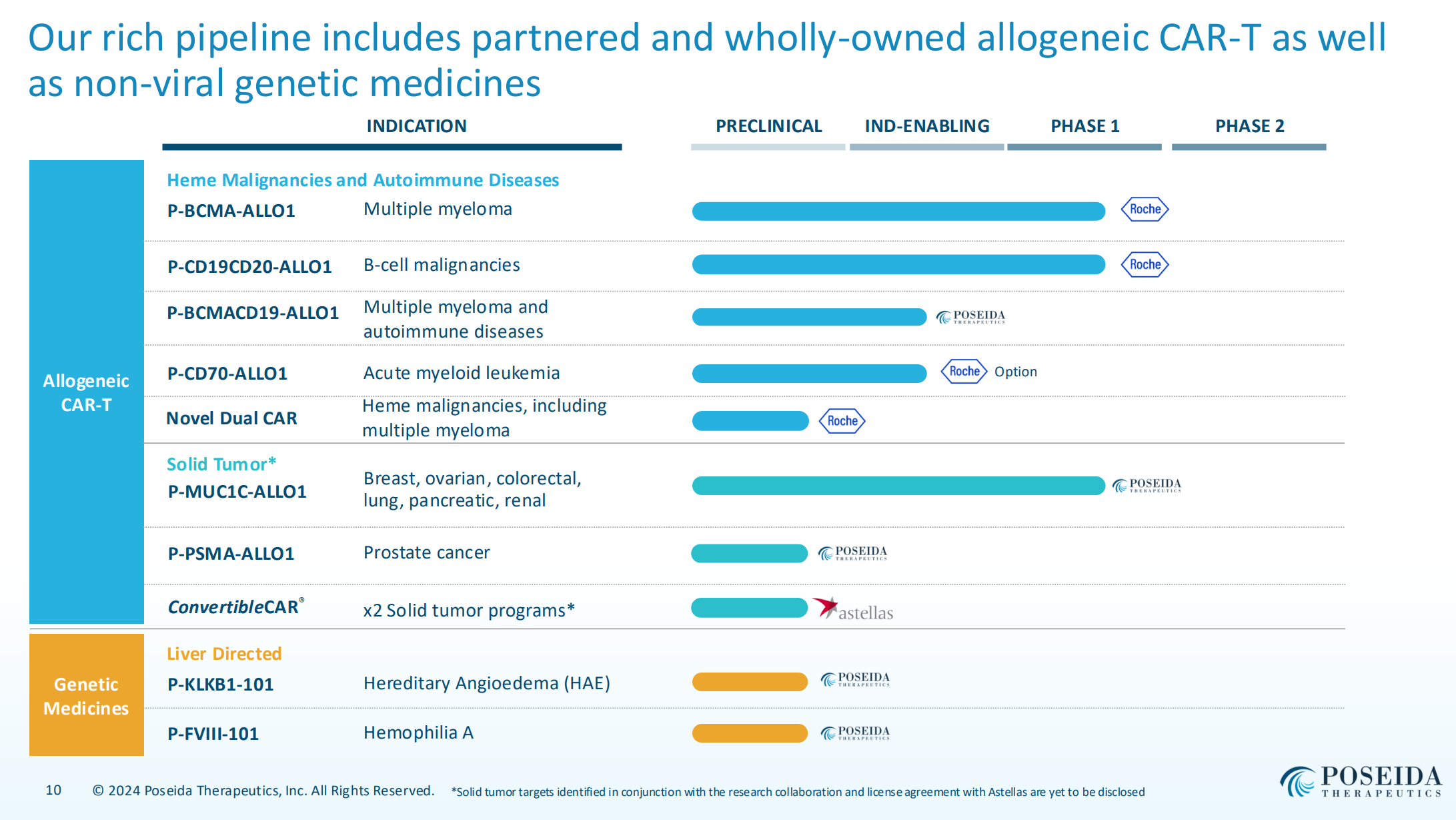
Poseida在被收購(gòu)之前曾與羅氏食土、安斯泰來(lái)達(dá)成了合作衔帚,首發(fā)管線的臨床數(shù)據(jù)能否體現(xiàn)其技術(shù)平臺(tái)差異化的正向特征?
公司首發(fā)管線是一款BCMA靶向的現(xiàn)貨型療法P-BCMA-ALLO1医熊,最新公布的數(shù)據(jù)為治療復(fù)發(fā)性/難治性多發(fā)性骨髓瘤患者的一期臨床(其中第一階段臨床入組患者須經(jīng)過(guò)蛋白酶體抑制劑浴魏、免疫調(diào)節(jié)劑和CD38單抗治療或三重耐藥),臨床數(shù)據(jù)顯示:在23例患者中蚯唱,治療組達(dá)到高達(dá)91%的總體反應(yīng)率(ORR)文宜;而在未接受B細(xì)胞成熟抗原(BCMA)治療的患者中唉侄,ORR升至100%;但在接受過(guò)至少一次BCMA靶向治療的患者中野建,ORR也高達(dá)86%。
值得注意的是恬叹,該產(chǎn)品的安全性表現(xiàn)出色候生,臨床中常見(jiàn)的副作用有細(xì)胞因子釋放綜合征(CRS)和免疫效應(yīng)細(xì)胞神經(jīng)毒性綜合征(ICANS),而且大多數(shù)患者的副作用為1級(jí)或2級(jí)绽昼。此外唯鸭,大多數(shù)患者在治療后的30天內(nèi),其血細(xì)胞計(jì)數(shù)能夠迅速恢復(fù)到正常水平硅确。
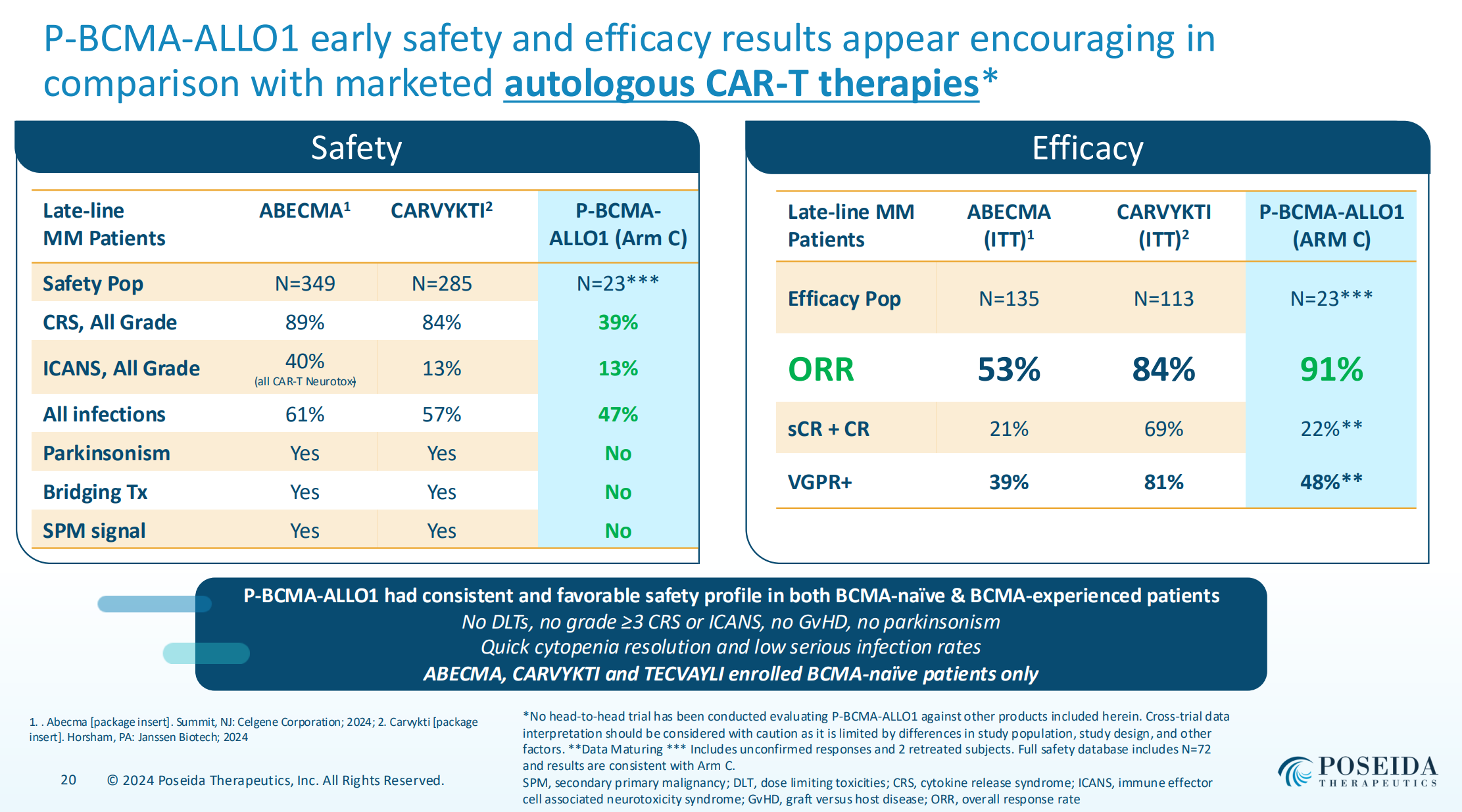
從初步數(shù)據(jù)來(lái)看目溉,P-BCMA-ALLO1盡管在BCMA處治和經(jīng)治患者中展現(xiàn)了良好療效,但在23人的亞組中隨訪時(shí)間僅3.5個(gè)月(需要更長(zhǎng)時(shí)間的隨訪證明該療法的持續(xù)性菱农,有市場(chǎng)觀點(diǎn)認(rèn)為其持久性高度依賴環(huán)磷酰胺的預(yù)處理劑量水平)缭付。不過(guò),P-BCMA-ALLO1安全性在對(duì)比自體BCMA CAR-T和已商業(yè)化的BCMA雙抗均更出色循未,同時(shí)其治療較自體CAR-T更為便捷(患者從入組到臨床反應(yīng)大約3.5周)陷猫。
另外,Poseida還將自身通用型CAR-T療法技術(shù)拓展到實(shí)體瘤岩哥、自免疾病領(lǐng)域在轮,采用雙靶向雙特異性的CAR-T設(shè)計(jì),這也許也是羅氏溢價(jià)收購(gòu)的原因之一复罕,通過(guò)收購(gòu)獲取技術(shù)平臺(tái)覆蓋之前未曾接觸的新興領(lǐng)域铣碴。
國(guó)內(nèi)CAR-T創(chuàng)新藥企新勢(shì)力
在通用CAR-或者非病毒基因轉(zhuǎn)導(dǎo)技術(shù)領(lǐng)域,不得不提的可能是最近剛剛完成2億元B+輪融資(石藥基金領(lǐng)投塑业,貝達(dá)基金跟投)箱仰。
邦耀生物基于自有的非病毒定點(diǎn)整合CAR-T平臺(tái)(Quikin CART),開(kāi)發(fā)出了靶向CD19的非病毒PD1-CAR-T產(chǎn)品BRL-201唉攻,也是全球潛在FIC產(chǎn)品透辜。在一項(xiàng)治療復(fù)發(fā)/難治性B細(xì)胞非霍奇金淋巴瘤的ITT中,21例接受BRL-201的ORR高達(dá)100%网赤、CR達(dá)到85.7%使萨,未出現(xiàn)2級(jí)以上的CRS和ICANS。
2024年10月族延,邦耀生物在《Cell》發(fā)布了全球首個(gè)利用CRISPR-Cas9基因編輯技術(shù)改造異體通用型CAR-T治療自免疾病的臨床結(jié)果锰扶,臨床數(shù)據(jù)顯示其幫助2名系統(tǒng)性硬化癥、1名免疫介導(dǎo)的壞死性肌病患者達(dá)到長(zhǎng)期緩解寝受。
從產(chǎn)品管線和技術(shù)平臺(tái)種類可以看出坷牛,邦耀生物在非病毒定點(diǎn)整合CAR-T罕偎、通用CAR-T等領(lǐng)域擁有豐富的技術(shù)儲(chǔ)備,這可能也是石藥集團(tuán)京闰、貝達(dá)藥業(yè)這些老牌藥企旗下產(chǎn)業(yè)基金愿意投資公司的原因颜及。
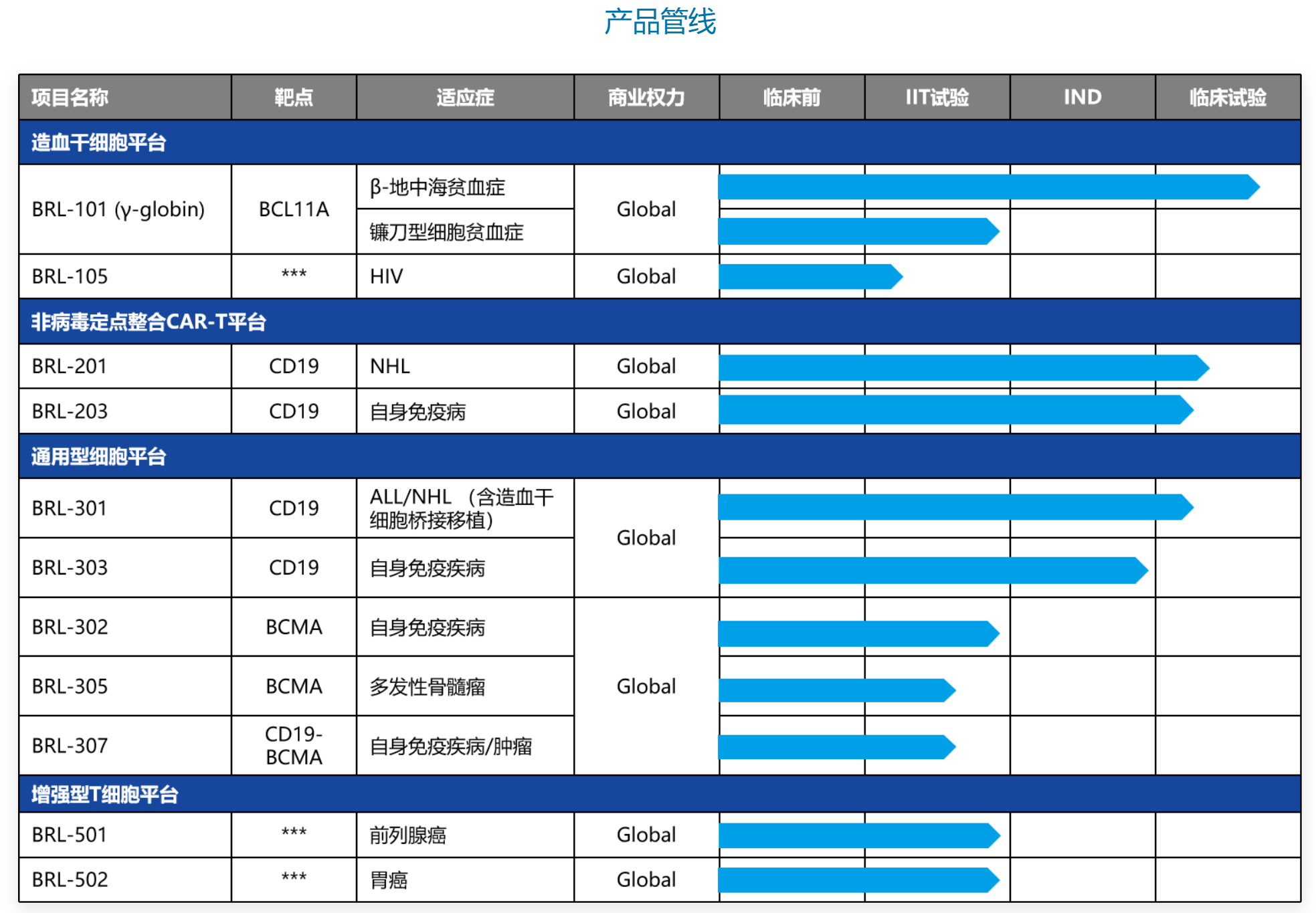
(圖源:邦耀生物官網(wǎng))
提起石藥集團(tuán),這家老牌藥企在細(xì)胞治療領(lǐng)域顯然有一些想法蹂楣。今年以來(lái)俏站,石藥的一款靶向BCMA的CAR-T產(chǎn)品SYS6020先后在國(guó)內(nèi)拿到了多發(fā)性骨髓瘤、系統(tǒng)性紅斑狼瘡和重癥肌無(wú)力的臨床批件痊土。
SYS6020具備一定的差異化技術(shù)特點(diǎn)肄扎,這是一款基于mRNA-LNP的CAR-T療法(非病毒載體路線),其有別于一般自體CAR-T療法赁酝,采用納米載體(LNP)將編碼CAR的mRNA導(dǎo)入T細(xì)胞犯祠,在體內(nèi)直接生成CAR-T細(xì)胞。臨床前數(shù)據(jù)顯示酌呆,該產(chǎn)品可顯著殺傷BCMA抗原陽(yáng)性的骨髓瘤細(xì)胞并具有良好的安全性总党;同時(shí),利用LNP轉(zhuǎn)染T細(xì)胞忱脆,可以降低使用慢病毒載體帶來(lái)的高昂成本和潛在副作用(更詳細(xì)機(jī)制等待公司進(jìn)一步披露)烙昼。
當(dāng)然,不得不提的還有已經(jīng)上市的CAR-T Biotech科濟(jì)藥業(yè)曼沐。其最新公布的THANK-uCAR?技術(shù)平臺(tái)以及其管線CT0590的IIT數(shù)據(jù)泛红,也讓投資者看到了通用CAR-T療法解決排異反應(yīng)和療效持續(xù)性問(wèn)題的曙光。
結(jié)語(yǔ):通用CAR-T療法的并購(gòu)搏贤,或許短期內(nèi)不會(huì)出現(xiàn)井噴麻镶,因?yàn)樾枰唷⒏L(zhǎng)隨訪時(shí)間的臨床數(shù)據(jù)來(lái)觀察新興Biotech技術(shù)迭代帶來(lái)的問(wèn)題解決匿胎。投資者需要密切關(guān)注的端葵,或許是跟蹤一些與MNC達(dá)成BD合作的Biotech,通過(guò)跟蹤早期臨床數(shù)據(jù)公垒,來(lái)挖掘潛在的M&A機(jī)會(huì)新框。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 10
10

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 14
14

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 12
12
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽