
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-05-11
2024-05-11
 377
377
“同質(zhì)化競爭”和“內(nèi)卷”是近些年伴隨中國創(chuàng)新藥產(chǎn)業(yè)發(fā)展壯大一直被詬病的問題邀杏。但凡事皆有兩面性,正是“內(nèi)卷”背后飽和式的資金普易、人才等研發(fā)資源投入潘酗,才鍛造升級了中國創(chuàng)新藥產(chǎn)業(yè)的整個生態(tài),促成中國創(chuàng)新藥融入全球版圖并適應(yīng)國際市場競爭的游戲規(guī)則半火,也讓我們看到中國的創(chuàng)新藥企業(yè)從研發(fā)到商業(yè)化褐琼、從BD到并購不斷取得刷新里程碑的成績冀烘。
醫(yī)藥魔方近期舉辦了一場解讀《醫(yī)藥魔方全球創(chuàng)新藥臨床研究》報(bào)告的線上直播,邀請到清華大學(xué)醫(yī)學(xué)院研究員陳曉媛教授和阿斯利康全球研發(fā)中國中心總裁何靜博士作為點(diǎn)評嘉賓军笑。兩位深度參與中國創(chuàng)新藥產(chǎn)業(yè)生態(tài)升級的資深專家從臨床研究角度也發(fā)表了各自對于“內(nèi)卷”的看法雨株。
陳曉媛教授指出:“我覺得‘扎堆’是一個不可避免的過程,從仿制藥到仿創(chuàng)結(jié)合擅暴、再到首創(chuàng)是中國藥企研發(fā)實(shí)力進(jìn)階的必經(jīng)之路贫迫。從這幾年的情況來看,國內(nèi)藥企已經(jīng)在下功夫探索全新的技術(shù)项栈,也在嘗試開發(fā)first in class分子或是best in class分子手欣。中國企業(yè)在ADC賽道上的表現(xiàn)就是在內(nèi)卷中得到成長的一個證明,很多產(chǎn)品已經(jīng)從簡單的follow走向差異化設(shè)計(jì)搁突。其實(shí)這兩年中國創(chuàng)新藥行業(yè)的研發(fā)熱點(diǎn)從腫瘤領(lǐng)域向非腫瘤領(lǐng)域過渡绍绽,也是國內(nèi)藥企對‘內(nèi)卷’競爭態(tài)勢的破局選擇,這也讓非腫瘤疾病患者的需求被進(jìn)一步看到经磅。”
“過去幾年钮追,國內(nèi)藥企扎堆在同一靶點(diǎn)的情況非常常見预厌,但這也并非全是壞處。這對中國臨床開發(fā)生態(tài)系統(tǒng)其實(shí)是一次非常好的試煉元媚。從fast follow模式起步的傳統(tǒng)藥企或是初生Biotech可以迅速在藥物開發(fā)流程上得到很好的成長轧叽,這也為中國藥企后續(xù)重度參與全球創(chuàng)新藥開發(fā)潮流的變化打下了堅(jiān)實(shí)的基礎(chǔ)】兀”何靜博士同樣從國內(nèi)創(chuàng)新藥行業(yè)過去幾年的“內(nèi)卷化競爭”中看到了積極的一面炭晒。
其實(shí)從近5年的創(chuàng)新藥臨床研究趨勢上,也能觀察到中國創(chuàng)新藥企業(yè)在內(nèi)卷中進(jìn)化的脈絡(luò)甥角。
整體來看网严,中國企業(yè)啟動的創(chuàng)新藥臨床研究數(shù)量逐年增加,并且在2023年大幅超越了美國企業(yè)嗤无。自2021年下半年生物醫(yī)藥行業(yè)開始面臨嚴(yán)峻融資環(huán)境以來震束,為了降本增效“過冬”,眾多企業(yè)都對其研發(fā)管線和公司架構(gòu)進(jìn)行了大大小小的調(diào)整咸婿。這也是全球創(chuàng)新藥臨床研究數(shù)量開始走低的重要原因姚转。中國企業(yè)卻出現(xiàn)了“逆勢增長”的現(xiàn)象。在陳曉媛教授看來棒嚼,這實(shí)際上反映了國內(nèi)藥企前幾年在靶點(diǎn)研究上的投入開始收獲成果们敢,一大批創(chuàng)新分子順利從臨床前階段邁入臨床階段。

來源:醫(yī)藥魔方全球創(chuàng)新藥臨床研究報(bào)告
從另一個宏觀統(tǒng)計(jì)角度來看啃掠,中國地區(qū)啟動的創(chuàng)新藥臨床研究數(shù)量在2023年也首次超過美國慷训。
這背后的原因也值得品味。一方面是因?yàn)橹袊髽I(yè)自己推進(jìn)至臨床階段的創(chuàng)新藥數(shù)量實(shí)現(xiàn)了飛躍。統(tǒng)計(jì)數(shù)據(jù)顯示巫邻,近5年中國企業(yè)的首次人體臨床研究(first in human猫荤,F(xiàn)IH)創(chuàng)新藥數(shù)量和占比均穩(wěn)步提升,尤其是2023年的數(shù)量和占比大幅提升溺察,顯著超過美國企業(yè)瞭芬。國家藥監(jiān)局發(fā)布的《2023年藥品審評報(bào)告》也佐證了這一點(diǎn),2023年IND申請數(shù)量相比2022年增長了33.56%矫评,達(dá)到歷史新高卜壕。
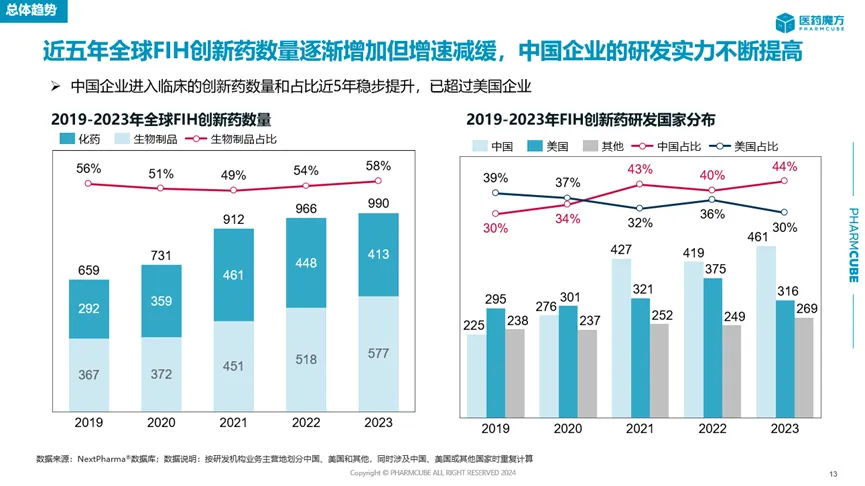
來源:醫(yī)藥魔方全球創(chuàng)新藥臨床研究報(bào)告
另一方面,中國市場正在成為海外藥企實(shí)現(xiàn)全球化開發(fā)的重點(diǎn)開拓目標(biāo)烙常,吸引更多的海外藥企來華開展創(chuàng)新藥臨床研究轴捎。
在MNC公司工作多年的何靜博士對此感同身受。她認(rèn)為外企戰(zhàn)略變化也會對中國地區(qū)的創(chuàng)新藥臨床研究數(shù)量帶來一定影響蚕脏≌旄保“全球同步研發(fā)是MNC在前幾年開始推行的策略,那時候首要目標(biāo)是確保中國能夠加入全球驗(yàn)證性III期研究的隊(duì)伍⊥毡蓿現(xiàn)在這種趨勢已經(jīng)發(fā)生了變化秦驯,MNC更加希望在早期階段即實(shí)現(xiàn)全球同步研發(fā)≌踝兀”何靜博士指出译隘。
與此同時,中國FIH創(chuàng)新藥往中后期階段推進(jìn)的成功率也在提高洛心。相比于美國企業(yè)固耘,中國藥企在近5年繼續(xù)推進(jìn)創(chuàng)新藥臨床研究進(jìn)入II期或III期以上階段的比例更高,說明順利從早期開發(fā)進(jìn)入中后期開發(fā)的創(chuàng)新藥或其適應(yīng)癥數(shù)量更多词身。
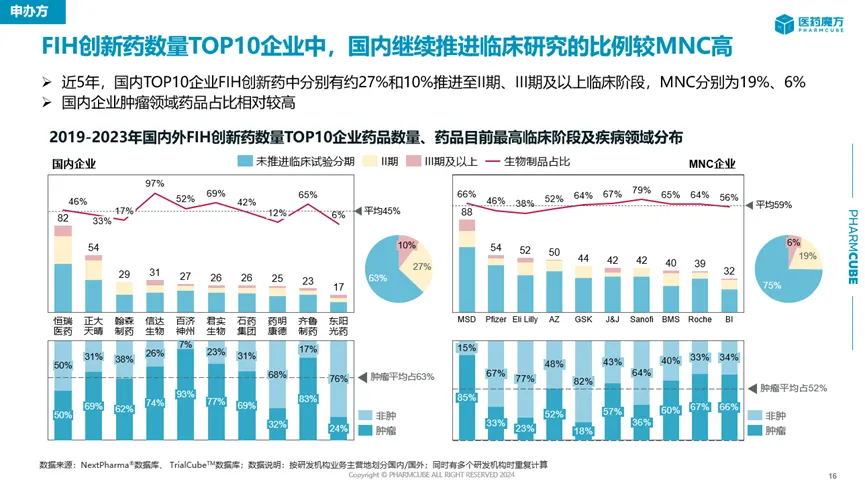
來源:醫(yī)藥魔方全球創(chuàng)新藥臨床研究報(bào)告
雖然數(shù)量上顯示了進(jìn)步厅目,但是中國創(chuàng)新藥這種臨床開發(fā)上的高推進(jìn)效率實(shí)際上是與中國藥企絕大多數(shù)還是在做follow項(xiàng)目相關(guān)。目前哪峰,瞄準(zhǔn)first in class新靶點(diǎn)開發(fā)的國產(chǎn)創(chuàng)新藥占比還在較低個位數(shù)的水平冷吏,要追趕海外藥企的步伐有一定差距。
不過在過往的fast follow模式中守搬,除了藥物設(shè)計(jì)和臨床前研究些惑,國內(nèi)企業(yè)可以得到的另一個重要成長便是臨床開發(fā)經(jīng)驗(yàn)的積累。明確適應(yīng)癥杰趾、劃分生物標(biāo)志物鲸锻、篩選患者等多個方面均可以影響臨床試驗(yàn)的結(jié)果。在千錘百煉之后稀销,企業(yè)在推進(jìn)創(chuàng)新藥的臨床開發(fā)上會更加得心應(yīng)手鸡捉。
陳曉媛教授對此評論道:“FIC藥物的開發(fā)風(fēng)險很高,開發(fā)周期也很長,從基礎(chǔ)研究到最后上市可能要經(jīng)歷二三十年的時間甚岩,很難指望國內(nèi)企業(yè)在短時間內(nèi)實(shí)現(xiàn)突破〖矗現(xiàn)階段,中國幾乎沒有一個企業(yè)能夠承擔(dān)這么長時間的投入涡相。公司的體量必須夠大哲泊,才能有足夠的實(shí)力追求在全新靶點(diǎn)上的長期投入。現(xiàn)在最重要的還是不停地打磨自己催蝗。做me better或者me best是一個平衡風(fēng)險的選擇切威,而且大家已經(jīng)在思考如何在早期開發(fā)階段進(jìn)行差異化設(shè)計(jì)”牛”
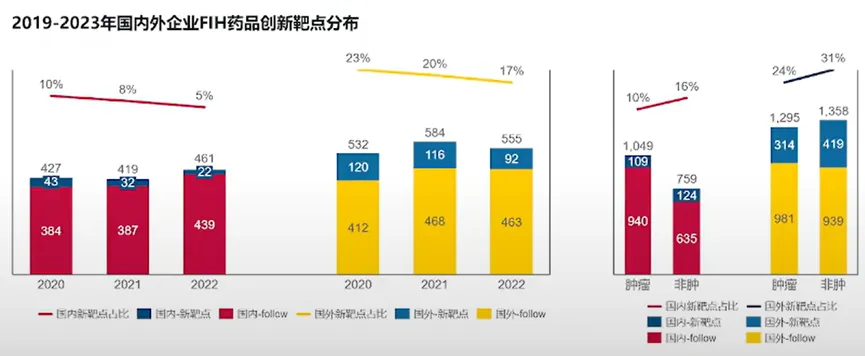
來源:醫(yī)藥魔方NextPharma數(shù)據(jù)團(tuán)隊(duì)
澤布替尼是國內(nèi)藥企在臨床開發(fā)差異化設(shè)計(jì)上的典范先朦。作為百濟(jì)神州打入全球市場的先行產(chǎn)品,去年年初澤布替尼在與伊布替尼的對壘之戰(zhàn)中獲勝犬缨,證明了其BIC實(shí)力喳魏。不僅如此,澤布替尼也憑借持續(xù)深入的海外市場滲透怀薛,成為首個國產(chǎn)“十億美元分子”截酷。
在澤布替尼之后,也有更多的國產(chǎn)創(chuàng)新藥踏上了挑戰(zhàn)海外標(biāo)桿產(chǎn)品的征服之路乾戏,例如TY-9591、LZM012三热、IBI362等鼓择。
2023年以來啟動的國產(chǎn)創(chuàng)新藥頭對頭III期研究
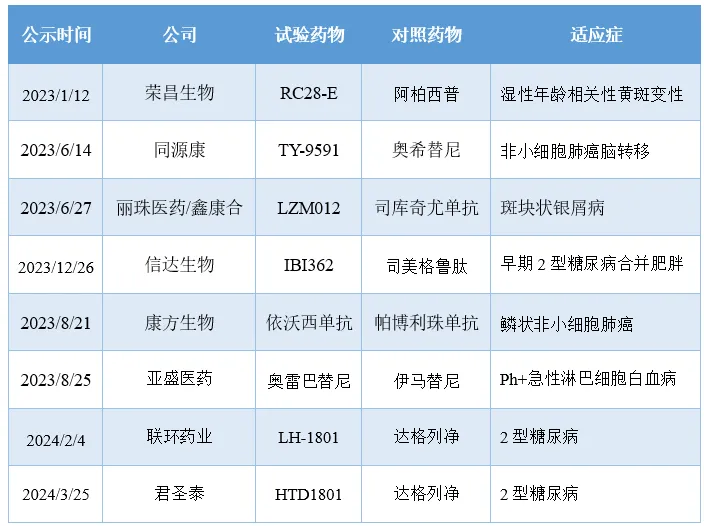
注:數(shù)據(jù)來源于醫(yī)藥魔方數(shù)據(jù)庫。
從企業(yè)的緯度看澈嘱,盡管中國藥企正在積極開展臨床研究奔赴創(chuàng)新藥市場的讯,但是國內(nèi)頭部企業(yè)與MNC相比仍有較大差距,僅恒瑞醫(yī)藥和正大天晴可以在創(chuàng)新藥臨床研究數(shù)量上追齊MNC收黔。
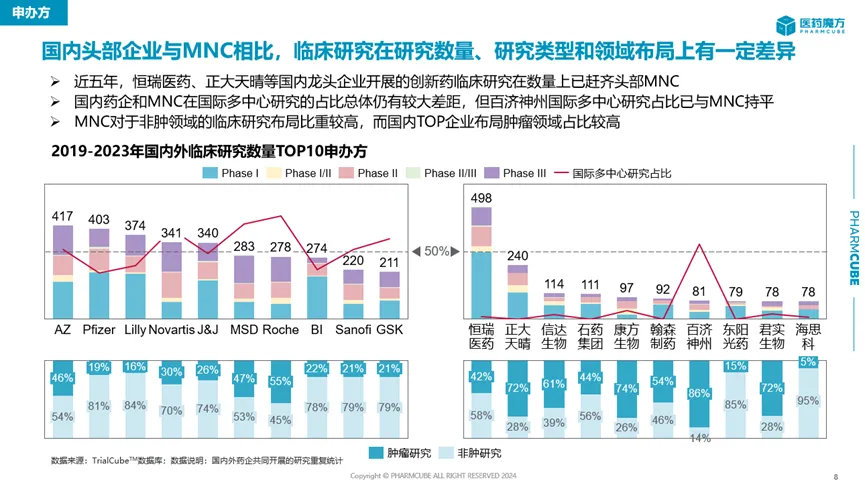
來源:醫(yī)藥魔方全球創(chuàng)新藥臨床研究報(bào)告
恒瑞醫(yī)藥2023年財(cái)報(bào)信息顯示某现,旗下超100款新分子處于臨床階段,數(shù)量遠(yuǎn)高于國內(nèi)同行颊嘱。正大天晴的在研項(xiàng)目數(shù)量雖與恒瑞醫(yī)藥有差距宋睦,但同樣已領(lǐng)先于其它藥企。這也是這兩家公司能夠在創(chuàng)新藥臨床研究數(shù)量上與MNC平分秋色的基礎(chǔ)所在腊拍。
國內(nèi)臨床研究數(shù)量TOP10企業(yè)管線分布

注:1)包括含有新分子且新分子尚未獨(dú)立成藥的復(fù)方藥物琐侣,已有適應(yīng)癥獲批的藥物不計(jì)在內(nèi),不包括劑型創(chuàng)新藥物呆淑;2)數(shù)據(jù)來源于醫(yī)藥魔方數(shù)據(jù)庫汇径。
百濟(jì)神州雖然在整體臨床研究數(shù)量上與MNC相差甚遠(yuǎn),但是其國際多中心研究占比已與MNC處于同一水平線上∈仿。“燒錢”是外界對于百濟(jì)神州做新藥開發(fā)的普遍印象魂务,其中一個重要原因就是敢于開設(shè)海外注冊性III期臨床試驗(yàn)。
澤布替尼泌射、替雷利珠單抗粘姜、歐司珀利單抗是百濟(jì)神州搶占腫瘤市場的三大拳頭產(chǎn)品,均已開展多項(xiàng)國際多中心III期臨床魄幕。其中相艇,澤布替尼是其摸索國際多中心開發(fā)路徑的試驗(yàn)石,也是最快從中獲益的產(chǎn)品纯陨。作為首款獲得FDA批準(zhǔn)的國產(chǎn)創(chuàng)新藥坛芽,澤布替尼開啟了國產(chǎn)創(chuàng)新藥征戰(zhàn)歐美市場的新篇章,年銷售額不斷攀升翼抠,如今已經(jīng)跨過“重磅炸彈”的10億美元門檻咙轩,2024年Q1銷售收入達(dá)到4.89億美元,同比增長132%阴颖。
去年秋天活喊,百濟(jì)神州Bcl-2抑制劑Sonrotoclax再啟動全球性頭對頭III期臨床研究,拉開了血液瘤領(lǐng)域新一輪競賽的序幕孽衩。
2023年國內(nèi)藥企研發(fā)投入TOP10
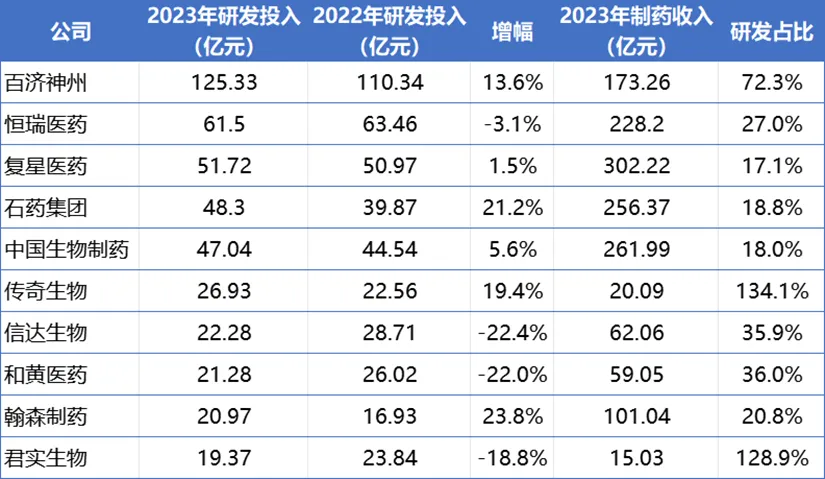
來源:醫(yī)藥魔方整理
總之箫俯,創(chuàng)新藥臨床研究只是體現(xiàn)中國藥企研發(fā)實(shí)力的一個側(cè)面。越來越多的出海交易陌沟,頻繁亮相國際學(xué)術(shù)舞臺的研發(fā)成果怕事,以及MNC并購中國Biotech事件,也在宣告著中國藥企的崛起截巢。近年來旅测,國家鼓勵創(chuàng)新藥開發(fā)的力度日漸加大,不管是傳統(tǒng)藥企還是新生代Biotech都可以有更足的底氣嘗試開拓FIC領(lǐng)域呻蚪,去創(chuàng)造誕自中國的first in class分子兆布。在“內(nèi)卷”中成長的中國藥企,在等待一個撕掉“內(nèi)卷”標(biāo)簽的時刻础姚。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 85
85

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 87
87

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 90
90
 熱門資訊
熱門資訊