
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 研發(fā)客
研發(fā)客  2024-05-11
2024-05-11
 569
569
各地出臺鼓勵生物醫(yī)藥創(chuàng)新的政策牽動著藥品注冊人的心弦蜀。在藥政法規(guī)科學年會上扰魂,與會者探討了如何應(yīng)對國際不同監(jiān)管要求成功出海固脸、如何通過臨床試驗一道道“高考”關(guān)卡踱稍,以及我國本土公司如何在“雙軌制”監(jiān)管下自信泣侮、高質(zhì)量地完成細胞治療的國際多中心臨床試驗等話題述雾。
“為了鼓勵藥物研發(fā)友酱,政府部門陸續(xù)出臺多種舉措,涉及研發(fā)刑顺、審批氯窍、進院、支付蹲堂、投融資五大關(guān)鍵環(huán)節(jié)狼讨,讓我們不由期待一個支持我國創(chuàng)新藥行業(yè)發(fā)展的頂層設(shè)計或?qū)⒊雠_贝淤。此外,上海政供、北京播聪、廣州和珠海等地也陸續(xù)發(fā)布支持生物醫(yī)藥創(chuàng)新的若干措施政策,著力提升創(chuàng)新醫(yī)藥臨床研究質(zhì)效和助力加速創(chuàng)新藥械審評審批布隔。春風迎面吹來了离陶。”日前衅檀,泰格醫(yī)藥政策法規(guī)事務(wù)副總裁常建青在泰格醫(yī)藥與研發(fā)客聯(lián)合舉辦的藥政法規(guī)科學年會上說枕磁。
李錦:復(fù)宏漢霖全球布局戰(zhàn)略考量
復(fù)宏漢霖全球藥政注冊團隊熟悉多國監(jiān)管審批路徑,目前已有5款產(chǎn)品在中國上市杖烘,2款全球上市,獲得19項適應(yīng)癥批準奄刊,覆蓋超過40個國家和地區(qū)于抬。
擁有20年注冊經(jīng)驗的復(fù)宏漢霖藥政事務(wù)部總經(jīng)理李錦指出,在海外開展臨床試驗需要綜合考慮市場規(guī)模饱粟、注冊路徑元邻、定價策略、醫(yī)保準入等因素掖阶,并提前估算成本咒付。例如,澳大利亞對早期臨床試驗有激勵政策炮疲,且人種差異等也是考量重點枷斩。

李錦分享了FDA、歐盟EMA和日本PMDA在MRCT監(jiān)管要求的最新動態(tài):FDA正加強對受試者人種多樣性的關(guān)注虎叔,提高少數(shù)族裔的入組要求味测,這對中國企業(yè)構(gòu)成了挑戰(zhàn);日本PMDA為了加速藥物上市并提升在MRCT的競爭力铺坞,已取消在日本人群中進行1期試驗或藥學研究的硬性要求起宽。
最后,她介紹了復(fù)宏漢霖的漢曲優(yōu)(曲妥珠單抗)作為首個國際多中心3期研究的國產(chǎn)生物類似藥济榨,已于2020年7月和8月在歐盟和中國上市坯沪,是首個中歐獲批的國產(chǎn)單抗生物類似藥,就在上個月擒滑,該藥也獲FDA批準腐晾。

科越醫(yī)藥中國與亞太區(qū)研發(fā)與運營總裁閆慧老師主持了接下來的論壇。她指出橘忱,注冊人員與臨床人員在公司創(chuàng)新研發(fā)中具有不可或缺的地位赴魁。二者需要發(fā)揮各自專業(yè)優(yōu)勢卸奉,推動公司創(chuàng)新研發(fā)工作。
陳霞:關(guān)鍵臨床試驗猶如人生高考
泰格醫(yī)藥高級副總裁颖御、首席醫(yī)學官陳霞博士曾在北京協(xié)和醫(yī)院臨床藥理中心擔任副教授榄棵,并在藥審中心擔任審評員,在審評部門潘拱、研發(fā)單位及醫(yī)院三大領(lǐng)域都積累了深厚的工作經(jīng)驗疹鳄。
她把開展關(guān)鍵臨床試驗在藥物研發(fā)中的地位,比喻為人生中高考唠芋,從實現(xiàn)考上大學的短期目標摹钳,到選擇優(yōu)質(zhì)專業(yè)的中期目標,再到從知名學府畢業(yè)最終成就人生巔峰的長遠目標拧淘。
與之類似疲席,關(guān)鍵臨床試驗也設(shè)定了清晰的目標體系。其近期目標族焰,首先是成功完成臨床試驗台古。CDE各項技術(shù)指導(dǎo)原則如同考試大綱一般重要。研發(fā)人員需要根據(jù)其要求進行試驗設(shè)計蚊凫,確保選擇人群和臨床終點能準確評估藥物的療效和安全性盲赚。

為了準備“考試”,研發(fā)人員需要回顧前期研究結(jié)果和分析肛英。與2期試驗相比膘椿,3期患者人群更為復(fù)雜多變。因此林索,在3期設(shè)計時笙隙,必須充分考慮到人群的差異,并確保樣本量的充足坎缭√友兀“有了考試大綱后還需要刷題,最終邁向沖刺階段幻锁】粒”陳霞說。
中期目標則要通過關(guān)鍵臨床試驗推動新藥上市哄尔。類比高考假消,主要關(guān)注研究結(jié)果是否達到主要、次要及關(guān)鍵次要終點岭接,顯示療效的穩(wěn)健性富拗。此外,安全性也至關(guān)重要鸣戴。

如同高考后選擇專業(yè)和學校一樣啃沪,選擇藥物的適應(yīng)癥在研發(fā)過程中至關(guān)重要粘拾。在3期關(guān)鍵試驗中,研發(fā)人員早在IND階段就應(yīng)有所規(guī)劃创千。到了3期奥债,需要更精準地界定適用人群,重點關(guān)注疾病嚴重的患者揖姆,并考慮其前期用藥及聯(lián)合用藥情況窥俊。
而到了NDA申請階段,需要提交完整的藥物研發(fā)信息眼厕,包括臨床藥理研究和群體藥代分析煮泪。這些研究不僅關(guān)注分層因素和亞組因素,還深入探索是否存在其他潛在因素影響劑量選擇半就。
最后酌非,新藥研發(fā)的遠期目標是使新藥成為重磅產(chǎn)品,為制藥公司帶來可觀的回報吸自。陳霞認為开辫,可以在早期試驗時進行前瞻性布局,實現(xiàn)長遠的發(fā)展目標役躬。

“總之,圍繞‘高考’目標柿糖,我們需要做好全方位準備纸兔,從試驗設(shè)計、受試者選擇否副、數(shù)據(jù)收集與分析等方面都要確保每一步都符合科學規(guī)范汉矿。同時還要密切關(guān)注市場動態(tài),以確保實現(xiàn)商業(yè)價值备禀≈弈矗”陳霞說。
趙戩:國產(chǎn)細胞治療駛?cè)肫椒€(wěn)發(fā)展車道
江蘇同凱集團副總裁及首席醫(yī)學官趙戩博士曲尸,曾負責諾華在中國第一項國際多中心臨床試驗赋续;將全球首款靶向治療藥物格列衛(wèi)引進中國,同時還撰寫GCP科普問答及翻譯ICH GCP另患,她先后獲得瑞士日內(nèi)瓦大學醫(yī)學博士及中歐高級工商管理碩士纽乱,是我國藥物臨床開發(fā)泰斗級的人物。
她首先分享自己親歷的注冊相關(guān)案例昆箕,如:諾華在中國成功完成第一項國際多中心臨床試驗鸦列,因為數(shù)據(jù)質(zhì)量可信首次將中國人的臨床試驗數(shù)據(jù)用于FDA申報;全球第一個靶向治療藥格列衛(wèi)拓展臨床試驗數(shù)據(jù)(真實世界數(shù)據(jù)研究)用于獲得中國進口注冊證批準鹏倘;通過全國試點將核酸檢測試劑用于血液篩查納入國家法定程序策退,保障國人用血安全电味。
她總結(jié)道,很多時候法規(guī)滯后于研發(fā)進程跑腮,需要注冊人用自己的智慧和能力推動新法規(guī)制定晌箍。注冊部門和臨床部門是藥械開發(fā)的一對“生死搭檔”,只有配合默契慰乾,藥械上市才能無往而不利妨试。而后她淺述細胞治療行業(yè)。
首先殊童,生物醫(yī)藥領(lǐng)域有三個廣為人知的“95%”词俏。這指的是藥品專利、高端醫(yī)療設(shè)備及醫(yī)院標準的規(guī)范指南中海泵,有95%都是外國人發(fā)現(xiàn)或發(fā)明的标腮,而我國則更多的是學習和改進∥вぃ“我真心希望在座的研發(fā)人員能夠共同努力祈很,讓中國在醫(yī)藥創(chuàng)新領(lǐng)域?qū)崿F(xiàn)更多從0到1的突破∧扑模”趙戩說道盗扒。
盡管中國臨床試驗行業(yè)普遍被認為在“722”以后已經(jīng)顯著規(guī)范,但趙戩呼吁缀去,藥廠和研究單位應(yīng)該認真開展臨床試驗侣灶,不能僅僅依賴CRC。特別是在細胞治療領(lǐng)域缕碎,IIT的研究質(zhì)量能否滿足藥審中心要求成為了一個嚴峻挑戰(zhàn)褥影。

自2020年以來,細胞治療行業(yè)在國家政策的推動下逐漸規(guī)范并升溫咏雌,受到衛(wèi)健委和藥監(jiān)局的雙重監(jiān)管凡怎。然而,細胞治療按藥品標準開展細胞治療臨床試驗面臨多重挑戰(zhàn)赊抖,如:臨床前動物模型的不足需深入探討臨床前到臨床轉(zhuǎn)化的可行性统倒;細胞治療作為“活藥”,需確保細胞來源可靠氛雪、無污染檐薯,并具備高質(zhì)量標準,同時關(guān)注細胞存活率挫勿、體內(nèi)穩(wěn)定狀態(tài)及與宿主的相互作用上辖。
“這些都與化學制藥完全不同∏倩”趙戩說绎探。細胞治療的臨床試驗獨具特色粉只,特別是長達1~2年的隨訪。判定其有效性和安全性時闲堆,需制定詳盡指標暇鸦,如臨床癥狀改善、生活質(zhì)量提升等捍辫。應(yīng)權(quán)衡需評估指標的關(guān)鍵影響牺胎。
細胞治療的重大挑戰(zhàn)在于其CMC環(huán)節(jié)。FDA在2020年因CMC問題拒絕了約14個產(chǎn)品沉年,突顯了這一環(huán)節(jié)的嚴格性暂一。為應(yīng)對這些挑戰(zhàn),企業(yè)需從源頭著手脾婚,不僅優(yōu)化生產(chǎn)工藝拐云,還需要確保高標準的質(zhì)量控制。這涵蓋了無菌智能化生產(chǎn)近她、制劑制備及凍存等關(guān)鍵步驟叉瘩,每個步驟都需要嚴格把控,以保障最終產(chǎn)品的安全性和有效性粘捎。
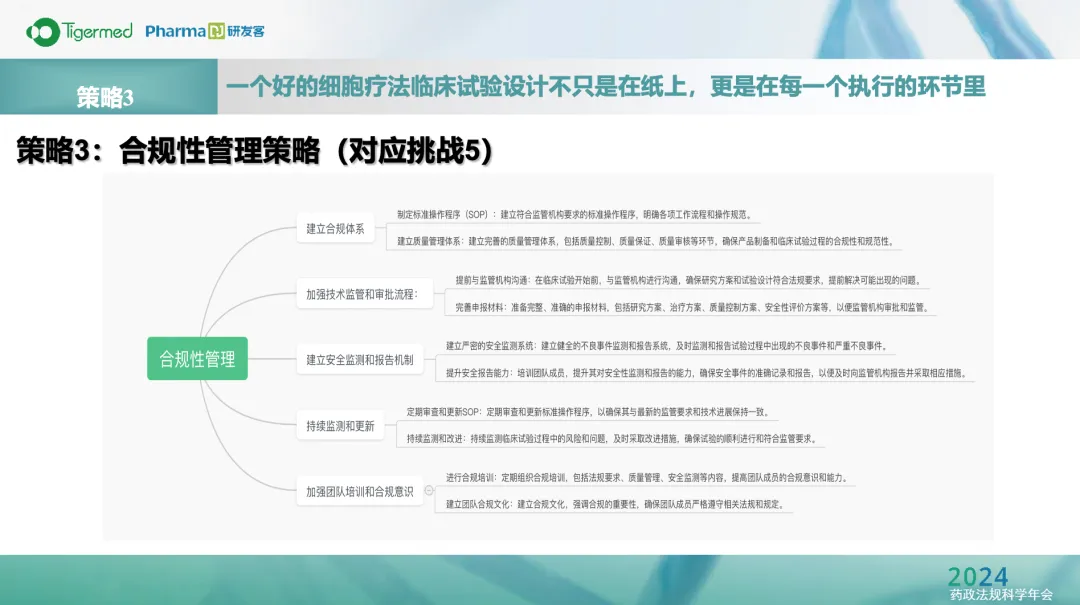
為此薇缅,趙戩從細胞療法的臨床試驗設(shè)計、實施攒磨、患者管理以及合規(guī)性方面著重強調(diào)泳桦。


趙戩還分享了一個新鮮出爐、引人關(guān)注的臨床試驗案例咧纠。去年10月,武田已上市的干細胞治療克羅恩病肛瘺新藥在3期臨床試驗中未達到主要終點泻骤。而江蘇同凱旗下的拓弘公司治療克羅恩病的同類細胞產(chǎn)品經(jīng)過1漆羔、2期臨床試驗已初顯成效,此時狱掂,武田在該領(lǐng)域因試驗失敗而退出演痒。
江蘇同凱團隊分析認為,從武田的試驗設(shè)計和中心分布來看陈伪,失敗的主要原因可能是研究中心數(shù)量急劇增加深牲,從52個擴展到了橫跨歐美、中東泛倦、亞洲等地區(qū)的159個辽松。由于這些國家存在顯著地域差異和法規(guī)差異,對MRCT的實施帶來極大挑戰(zhàn)习环。武田全球入組了544個病人裸努,相當于一個中心才入組3芦终、4個病人,只要一兩個數(shù)據(jù)結(jié)果有偏差就會影響試驗結(jié)果垃桨。因此武田大3期試驗失敗了也不足為奇眉堪。
“鑒于此,我們決定中國自己的試驗要繼續(xù)器赦,我們有信心把這個適應(yīng)癥用中國人的智慧和力量完成奉堵。”趙戩還建議選擇研究中心一定要高鐵8小時之內(nèi)能到達刚垦,以保證細胞相對穩(wěn)定抚垃,目前,同凱的第一個干細胞創(chuàng)新藥已啟動臨床3期载迄,進展速度應(yīng)為國內(nèi)第一梯隊讯柔。
最后,趙戩對中國院士團隊及研究者寄語:“我堅信护昧,中國的細胞及基因治療經(jīng)歷了從最初的跟跑到并跑魂迄,最終一定會領(lǐng)跑全球,中國的新藥一定會造福全人類惋耙〉肪妫”
余文心:全鏈條支持創(chuàng)新藥發(fā)展
今年兩會上,政府工作任務(wù)強調(diào)“大力推進現(xiàn)代化產(chǎn)業(yè)體系建設(shè)绽榛,加快發(fā)展新質(zhì)生產(chǎn)力”湿酸,提及“全鏈條支持創(chuàng)新藥發(fā)展,加快高端醫(yī)療器械研制及示范應(yīng)用”灭美,突顯創(chuàng)新藥在新興產(chǎn)業(yè)中的戰(zhàn)略意義推溃。
海通證券研究所副所長兼醫(yī)藥行業(yè)首席分析師余文心擁有多年醫(yī)藥投資和行業(yè)經(jīng)驗,她解讀了2024年兩會及創(chuàng)新藥產(chǎn)業(yè)未來發(fā)展之路届腐,回顧了A+H股的醫(yī)藥十年市值變遷万窄,總結(jié)了當下資本環(huán)境現(xiàn)狀和挑戰(zhàn)以及未來投資的關(guān)鍵點,以及表達了對中國Biotech對外授權(quán)產(chǎn)品的期待仪荞。
泰格醫(yī)藥自2019年發(fā)起成立泰格醫(yī)藥政策法規(guī)沙龍以來付忆,匯聚了國內(nèi)部分資深的藥品注冊專業(yè)人員,共同討論藥物研發(fā)的新政策江构、新問題和新策略艺退。研發(fā)客也始終追隨泰格醫(yī)藥法規(guī)沙龍專家的步伐,專注報道我國藥品注冊領(lǐng)域的最新動態(tài)在缆,反映注冊人員的心聲与钳。更多年會內(nèi)容,請見下期報道。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍觀
深藍觀  2024-11-28
2024-11-28
 85
85

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 87
87

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 90
90