
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-05-13
2024-05-13
 1015
1015
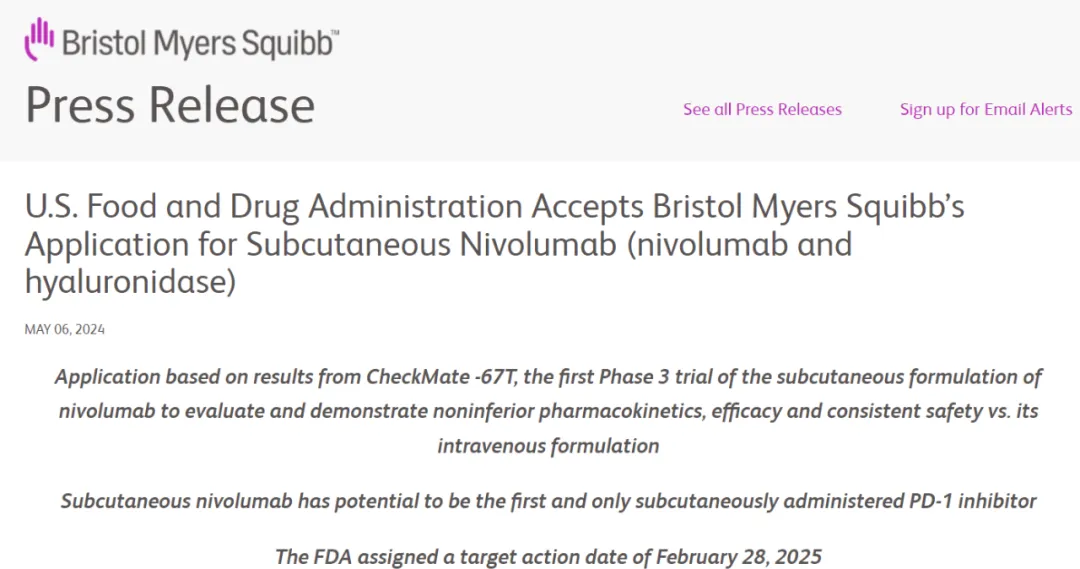
5月6日晃烟,BMS宣布FDA已經(jīng)受理納武利尤單抗(Opdivo,nivolumab)皮下注射制劑的生物制品許可申請(qǐng)(BLA)二娄,可用于Opdivo之前批準(zhǔn)上市的所有實(shí)體瘤適應(yīng)癥,包括單藥治療掷佑、聯(lián)合伊匹木單抗治療后的單藥維持苇恤、與化療或者卡博替尼聯(lián)合使用。PDUFA日期為2025年2月28日霹壁,有望成為首個(gè)獲批上市的皮下注射PD1抑制劑供窝。
納武利尤單抗皮下注射制劑由納武利尤單抗與Halozyme專有的重組人透明質(zhì)酸酶PH20(rHuPH20)組成。
本次上市申請(qǐng)主要是基于一項(xiàng)隨機(jī)剿稼、開(kāi)放標(biāo)簽的III期CheckMate-67T研究(N=495)數(shù)據(jù)百涕,該研究旨在評(píng)估皮下注射對(duì)比靜脈輸注納武利尤單抗在既往接受過(guò)全身治療的晚期或轉(zhuǎn)移性透明細(xì)胞腎細(xì)胞癌(ccRCC)患者中的療效。
結(jié)果顯示茂禁,與靜脈輸注納武利尤單抗相比斩角,皮下注射納武利尤單抗在28天內(nèi)平均血清濃度(Cavgd28)和穩(wěn)態(tài)血清低谷濃度(Cminss)指標(biāo)上均表現(xiàn)出非劣效性,達(dá)到共同主要終點(diǎn)瞻窗,幾何平均比值分別為2.098(90% Cl: 2.001-2.200)伶丐、1.774 (90% CI: 1.633-1.927)。
關(guān)鍵次要終點(diǎn)客觀緩解率(ORR)也顯示出非劣效性疯特,皮下注射納武利尤單抗組患者ORR為24.2%哗魂,而靜脈輸注組患者的ORR為18.2%(RR=1.33;95% CI: 0.94-1.87)辙芍,顯示出非劣效性啡彬;皮下注射納武利尤單抗組患者PFS為7.23個(gè)月,而后者該數(shù)值為5.65個(gè)月故硅。
安全性方面庶灿,皮下注射納武利尤單抗與靜脈輸注一致。皮下注射納武利尤單抗局部注射部位反應(yīng)發(fā)生率為8.1%吃衅,且均為低等級(jí)和短暫的往踢。此外,對(duì)于皮下注射劑型和靜脈注射劑型徘层,發(fā)生3-4級(jí)不良事件(AE)的患者比例分別為35.2%和40.8%峻呕,治療相關(guān)AE發(fā)生率分別為9.7%和14.7%,嚴(yán)重AE發(fā)生率分別為21.1%和22.9%趣效,治療相關(guān)嚴(yán)重AE發(fā)生率均為6.5%瘦癌。

 研發(fā)追蹤
研發(fā)追蹤
 藥時(shí)代
藥時(shí)代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽