
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥融圈
藥融圈  2024-05-14
2024-05-14
 557
557
精準(zhǔn)醫(yī)療在腫瘤領(lǐng)域的地位如今不可小覷柔滔。
癌癥精準(zhǔn)醫(yī)療的一個(gè)開創(chuàng)性例子摇零,是在晚期肺癌患者中開發(fā)針對(duì)EGFR的小分子抑制劑榄笙。接受EGFR抑制劑治療的EGFR突變患者的緩解率在65%范圍內(nèi)许蓖,而未經(jīng)選擇的肺部患者的緩解率約為10%令杈。早年Erlotinib (Tarceva?)是在美國(guó)被批準(zhǔn)作為以EGFR突變?yōu)樘卣鞯腘SCLC患者的一線治療藥物概丢,此外突妇,ALK、BCR-ABL膳灶、BRAF、ROS1立由、RET和TRK抑制劑等也是使用精準(zhǔn)醫(yī)學(xué)方法開發(fā)的批準(zhǔn)藥物轧钓。
今天要介紹的這家公司——Kura Oncology主攻精準(zhǔn)醫(yī)療領(lǐng)域,專注于研發(fā)用于治療實(shí)體瘤和血液癌癥的精準(zhǔn)藥物锐膜。
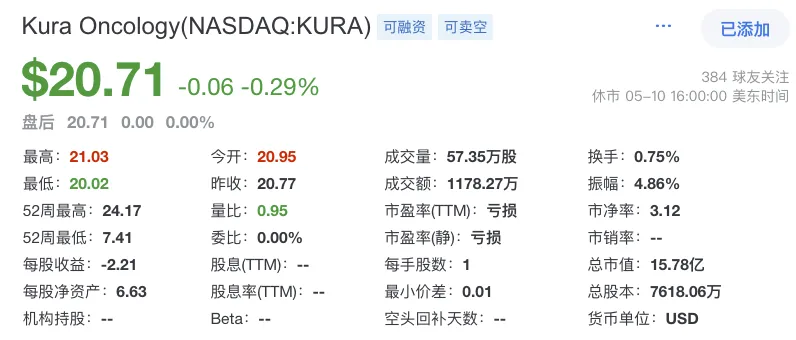
Kura成立于2014年毕箍,成立一年后,即2015年成功在納斯達(dá)克上市道盏。截至2024年2月28日而柑,Kura股價(jià)21.38美元/股,市值約16.28億美元荷逞;5月10日媒咳,約15.78億美元。發(fā)展10年來种远,該公司在10輪融資中共籌集到了10億美元資金涩澡。
01 發(fā)展歷史可溯自07年
2007年,Kura的核心初創(chuàng)團(tuán)隊(duì)成立坠敷,其中包括Troy Wilson博士和美國(guó)科學(xué)院院士Kevan M. Shokat教授汹涯,成立新藥公司Intellikine。在隨后的四年內(nèi)数屁,Intellikine將3種候選藥物帶至臨床片侧,用于治療小淋巴細(xì)胞性淋巴瘤的小分子藥物Duvelisib(度維利塞)于2018年經(jīng)FDA批準(zhǔn)上市希咒,國(guó)內(nèi)權(quán)益由石藥集團(tuán)持有。
2012年微悬,在出售Intellikine后(2011年被武田制藥/Takeda收購(gòu))顺良,Shokat基于加州大學(xué)舊金山分校(UCSF)的實(shí)驗(yàn)室所做的一些研究,提出創(chuàng)立新公司的想法详础,聯(lián)合劉異博士程挑、仁達(dá)平博士頂級(jí)華人科學(xué)家以研發(fā)共價(jià)抑制劑小分子藥物以期靶向致癌蛋白KRAS G12C,創(chuàng)立了Araxes Pharma普易。
“Araxes Pharma”這一名字是由Shokat提議命名的臊耳,它源于阿拉克斯河(Araxes)。Araxes經(jīng)土耳其畜股、亞美尼亞颈侈、阿塞拜疆和伊朗的河流,流經(jīng)小高加索山脈南側(cè)后闷旧,與庫(kù)拉河(Kura)匯合长豁,然后注入里海。此外忙灼,Shokat還被“Araxes”所吸引匠襟,因?yàn)樗?strong>翻譯為“A Ras”或簡(jiǎn)稱“Ras”,RAS分子途徑正是他在UCSF研究的重點(diǎn)该园。
而他們并沒有止步于Araxes酸舍,不久后,他們創(chuàng)立了Wellspring Biosciences(Araxes Pharma的子公司)——“Wellspring”即創(chuàng)新的“源頭”里初。
2014年8月啃勉,Wilson和Shokat、劉異博士及任平達(dá)博士一同創(chuàng)立了Kura Oncology双妨。此次他們將目光轉(zhuǎn)向Araxes的下游庫(kù)拉河(Kura)淮阐,并將新公司命名為Kura Oncology。(劉博后創(chuàng)立公司為Kumquat)
基于Araxes和Wellspring的此前創(chuàng)業(yè)經(jīng)驗(yàn)刁品,以及在Wilson及其核心團(tuán)隊(duì)的推進(jìn)下泣特,Kura乘上了快速發(fā)展的列車,推出了兩條全資擁有的小分子藥物研發(fā)管線蟹梗,且三個(gè)在研產(chǎn)品全部進(jìn)入臨床開發(fā)膜暴。
02 在研管線

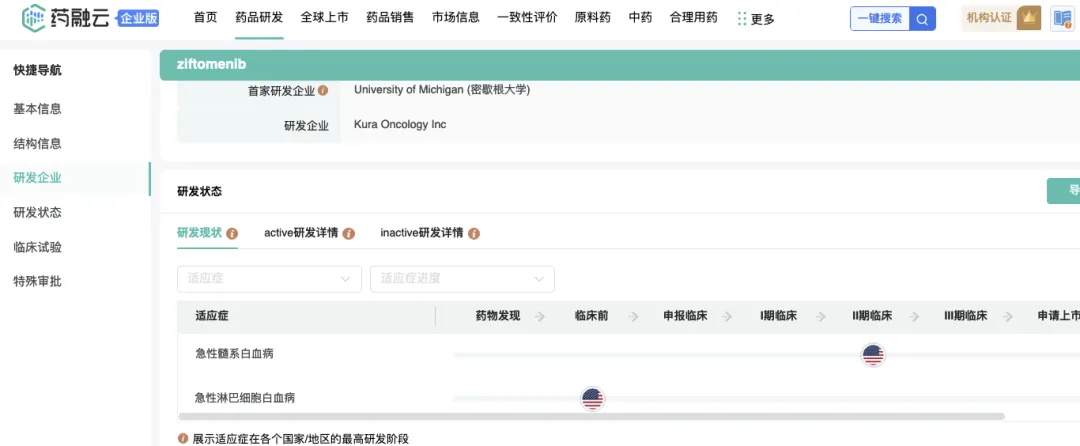
ZIFTOMENIB
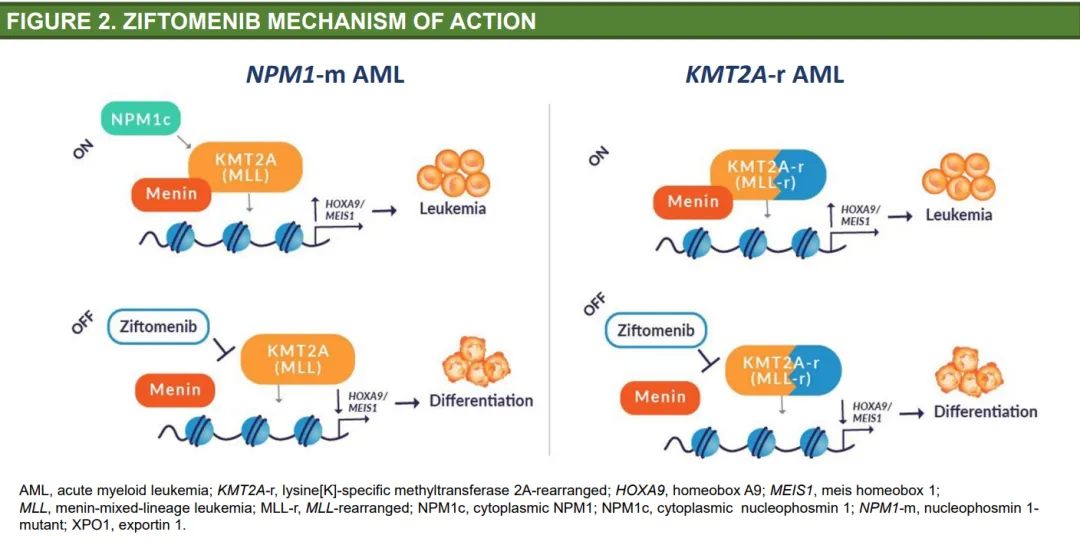
Kura的第一個(gè)候選產(chǎn)品Ziftomenib是一種口服的選擇性menin抑制劑,用于抑制menin與KMT2A/MLL蛋白復(fù)合體之間的相互作用尚稍,以治療攜帶特定基因突變的AML患者道暑。
藥融云數(shù)據(jù)www.pharnexcloud.com
在臨床前模型中,ziftomenib抑制了KMT2A/MLL蛋白復(fù)合體竭珊,并表現(xiàn)出強(qiáng)大的抗白血病活性人蕊。
2019年7月葬聘,Kura從美國(guó)食品和藥物管理局(FDA)獲得了Ziftomenib治療急性髓系白血病(AML)的孤兒藥指定锤镀。并于2019年9月啟動(dòng)了Ziftomenib治療復(fù)發(fā)性或難治性AML的全球Menin-KMT2A 1/2期臨床試驗(yàn)赖相,稱之為Kura Oncology Menin-KMT2A試驗(yàn),或KOMET-001手索。
在KOMET-001試驗(yàn)的1A期劑量遞增部分钳骚,在30名復(fù)發(fā)性或難治性AML患者中,Ziftomenib顯示出廣泛的治療窗口和令人鼓舞的單一治療活性唱枝。共有53名患者在試驗(yàn)的1B期劑量驗(yàn)證和劑量擴(kuò)展部分接受治療貌嫡,該試驗(yàn)由兩個(gè)隨機(jī)擴(kuò)展隊(duì)列組成,每個(gè)隊(duì)列由核磷蛋白1-或NPM1-突變體和KMT2A-重排AML患者組成该溯。在KOMET-001試驗(yàn)的1B期部分岛抄,Ziftomenib在600 mg時(shí)顯示出最佳的臨床效益,該劑量被指定為推薦的2期劑量(RP2D)狈茉。
2023年6月11日夫椭,在德國(guó)法蘭克福舉行的2023年歐洲血液學(xué)協(xié)會(huì)年度大會(huì)(EHA)的最新口頭會(huì)議上,Kura公布了KOMET-001的最新臨床數(shù)據(jù)氯庆,包括1B期的數(shù)據(jù)蹭秋,包括重度預(yù)處理和共突變的復(fù)發(fā)或難治性NPM1突變AML患者的持久活性。
截至2023年4月12日的數(shù)據(jù)截止日期堤撵,20名接受600 mg RP2D治療的NPM1突變AML患者中有7名(35%)達(dá)到完全緩解(Cr)感凤,計(jì)數(shù)完全恢復(fù)。第八名患者在接受Ziftomenib治療后出現(xiàn)部分計(jì)數(shù)恢復(fù)的Cr粒督,隨后在造血細(xì)胞移植(HCT)后出現(xiàn)完全計(jì)數(shù)恢復(fù)的Cr,并在EHA報(bào)告之日仍在研究中禽翼。
此外屠橄,一名接受200 mg治療的NPM1突變型AML患者在數(shù)據(jù)截止時(shí)繼續(xù)接受36個(gè)周期的Ziftomenib治療。在接受Ziftomenib治療的NPM1突變和其他關(guān)鍵共突變患者中觀察到持久緩解硫忆。值得注意的是筷资,33%(2/6)的FLT3共突變患者、50%(4/8)的異檸檬酸脫氫酶或IDH共突變患者以及50%(2/4)的FLT3和IDH共突變患者在服用600 mg劑量的齊夫托梅尼時(shí)獲得了Cr袭丛。在接受600 mg劑量治療的NPM1突變AML患者中胃宰,Ziftomenib的總體緩解率(ORR)為45%。在研究的1A/B期部分饲骂,所有接受200 mg或600 mg治療的NPM1突變患者的中位緩解持續(xù)時(shí)間(DOR)為8.2個(gè)月(95%CI:1.0至NE)垦适,中位隨訪時(shí)間為8.8個(gè)月。這類患者在干細(xì)胞移植時(shí)的中位DOR為5.6個(gè)月(95%CI:1.0至NE)旋逛。
作為正在進(jìn)行的分析的一部分矛塑,在三名接受Ziftomenib治療的患者中檢測(cè)到耐藥突變MEN1-M3271:在這三名患者中的兩名患者中析口,該突變是在患者先前使用Menin抑制劑后進(jìn)展的研究開始時(shí)檢測(cè)到的,在第三名患者中媳厕,該突變是在Ziftomenib治療四個(gè)周期后檢測(cè)到的乱归,盡管存在突變,患者在整個(gè)第7周期均處于病情穩(wěn)定狀態(tài)睬魂。這些數(shù)據(jù)顯示终吼,僅有3%(1/29)的患者在接受Ziftomenib治療后發(fā)生了MEN1突變,這表明即使長(zhǎng)期接受Ziftomenib單藥治療氯哮,耐藥突變的發(fā)生率也很低际跪。晶體結(jié)構(gòu)證實(shí)的一項(xiàng)關(guān)鍵的新生化發(fā)現(xiàn)表明,Ziftomenib保留了對(duì)MEN1-T349M突變的結(jié)合親和力蛙粘,在最近的另一項(xiàng)MENIN抑制劑試驗(yàn)中垫卤,在三分之二獲得MENIN耐藥突變的患者中檢測(cè)到了該突變。Ziftomenib的連續(xù)每日給藥耐受性良好出牧,報(bào)告的不良事件特征與潛在疾病的特征一致穴肘。分化綜合征(DS)的目標(biāo)效應(yīng)是可控的,15%的患者出現(xiàn)1級(jí)或2級(jí)事件舔痕,5%的患者出現(xiàn)3級(jí)事件评抚。
2024年1月30日,Kura公布了KOMET-007研究中首批20名患者的初步數(shù)據(jù)伯复。首批20名患者在2023年7月至2023年11月期間入選KOMET-007慨代,包括5名新診斷的不良風(fēng)險(xiǎn)NPM1突變或KMT2A重排AML患者和15名復(fù)發(fā)或難治性NPM1突變或KMT2A重排AML患者。根據(jù)歐洲白血病網(wǎng)絡(luò)(European LeukemiaNet)啸如,如果患者年齡超過60歲和/或患有治療相關(guān)的急性髓細(xì)胞白血财氛选(AML)和/或細(xì)胞遺傳學(xué)不良風(fēng)險(xiǎn),則被視為“不良風(fēng)險(xiǎn)”影菩。
連續(xù)每日服用200 mg的Ziftomenib耐受性良好侍融,安全性與基礎(chǔ)疾病和骨干療法的特征一致。未報(bào)告任何級(jí)別的分化綜合征事件猜摹,也未觀察到劑量限制性毒性崇夫、QTc延長(zhǎng)、藥物相互作用或附加骨髓抑制的證據(jù)灿磁。
第二項(xiàng)ziftomenib聯(lián)合研究缭涣,稱之為KOMET-008,旨在評(píng)估ziftomenib聯(lián)合Gilteritinib治療復(fù)發(fā)或難治性NPM1突變型AML患者嫁橱,以及ziftomenib聯(lián)合氟達(dá)拉濱热阁、阿糖胞苷、粒細(xì)胞集落刺激因子或G-CSF、伊達(dá)比星或FLAG-IDA寝话、低劑量阿糖胞苷或LDAC治療復(fù)發(fā)或難治性NPM1突變型或KMT2A重排患者今燃。在2024年2月26日,Kura宣布給第一個(gè)病人服用了KOMET-008尊勿。

Kura計(jì)劃評(píng)估在接受HCT的NPM1突變或KMT2A重排AML患者中使用Ziftomenib作為維持治療僧凤。HCT是唯一可能治愈AML的治療方法,但HCT后長(zhǎng)期失敗的最常見原因是疾病復(fù)發(fā)元扔。該公司正在支持一項(xiàng)由研究者發(fā)起的研究躯保,并計(jì)劃啟動(dòng)一項(xiàng)由公司發(fā)起的研究,評(píng)估Ziftomenib在HCT后作為維持治療給藥時(shí)改善結(jié)果的能力澎语。預(yù)計(jì)在2024年第一季度啟動(dòng)移植后維護(hù)計(jì)劃途事。
2023年12月8日,Kura宣布與白血病和淋巴瘤協(xié)會(huì)(LLS)開展臨床合作擅羞,以評(píng)估ziftomenib聯(lián)合化療治療兒童復(fù)發(fā)性或難治性KMT2A重排尸变、NUP98重排或NPM1突變急性白血病的療效。根據(jù)合作協(xié)議的條款减俏,LLS將擔(dān)任Ziftomenib在北美急性白血病兒童患者中的一期研究的協(xié)調(diào)贊助商召烂,荷蘭烏得勒支的馬克西馬公主兒科腫瘤中心將擔(dān)任該研究在歐洲的協(xié)調(diào)贊助商,Kura將為L(zhǎng)LS和馬克西馬公主中心的研究提供Ziftomenib娃承。
關(guān)于AML
急性髓細(xì)胞性白血沧喾颉(Acute myeloid leukemia,AML)是成人最常見的急性白血病倒灰,其中艳杯,KMT2A(KMT2A -r)重排和NPM1(NPM1 -m)突變是AML中常見的蛋白變化。研究數(shù)據(jù)顯示茬蓝,約5%—10%的AML患者存在KMT2A重排1统褂,而約30%的AML患者存在NPM1突變2。
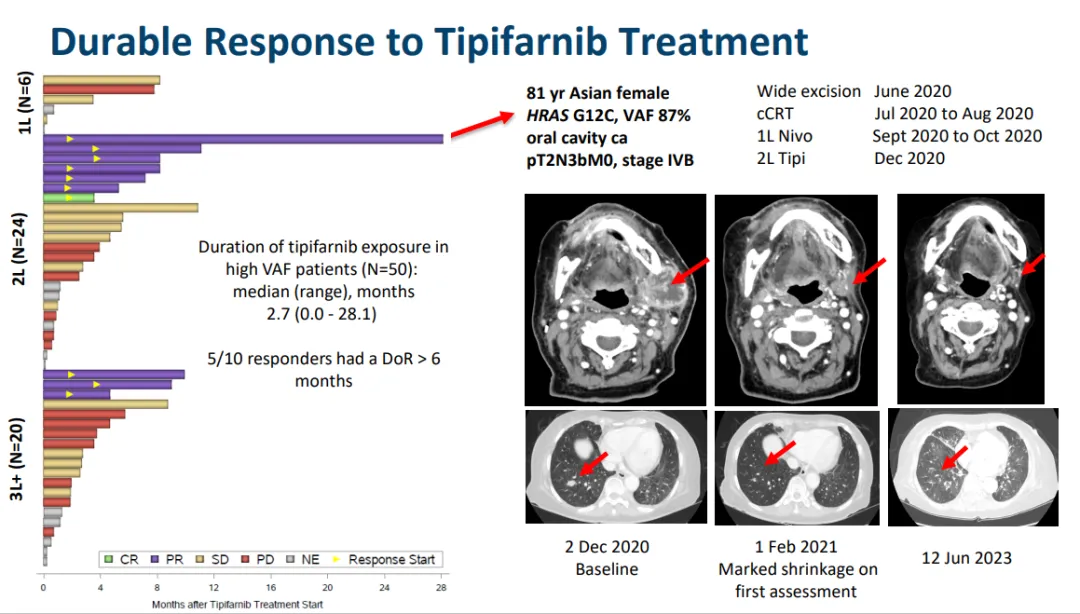
TIPIFARNIB
Kura的第二個(gè)候選產(chǎn)品Tipifarnib是一種強(qiáng)效桐夭、選擇性和口服生物可利用的法尼基轉(zhuǎn)移酶抑制劑(FTI)颗手,此前已在5000多名癌癥患者中進(jìn)行了研究,并在某些患者中表現(xiàn)出引人注目和持久的抗癌活性研脸,且副作用可控。2021年2月蚓橡,替匹法尼被FDA授予突破性治療指定或怜,用于治療復(fù)發(fā)性或轉(zhuǎn)移性HRAS突變頭頸部鱗狀細(xì)胞癌(HNSCC)患者,這些患者在接受以鉑為基礎(chǔ)的化療或高VAF后出現(xiàn)疾病進(jìn)展抠佩,且變異等位基因頻率≥20%归衫。
2021年7月,Kura宣布與諾華(Novartis)進(jìn)行臨床合作,以評(píng)估tipifarnib和Alpelisib(一種PI3激酶α抑制劑)在HNSCC患者中的聯(lián)合應(yīng)用蔫缸,這些患者的腫瘤具有HRAS過度表達(dá)和/或PIK3CA突變和/或擴(kuò)增腿准。在2021年第四季度,Kura開始了一項(xiàng)1/2期開放標(biāo)簽拾碌、生物標(biāo)志物定義的隊(duì)列研究吐葱,稱之為Kurrent-HN試驗(yàn),以評(píng)估聯(lián)合用藥的安全性和耐受性校翔,確定聯(lián)合用藥的推薦劑量和方案弟跑,并評(píng)估聯(lián)合用藥治療此類患者的早期抗腫瘤活性。

根據(jù)該公司與諾華公司的合作協(xié)議條款防症,Kura贊助Kurrent-HN試驗(yàn)并供應(yīng)Tipifarnib孟辑,諾華公司供應(yīng)Alpelisib。2021年12月蔫敲,Kura宣布對(duì)Kurrent-HN的PIK3CA隊(duì)列中的第一名患者進(jìn)行劑量給藥饲嗽。
2022年10月,首次報(bào)道了聯(lián)合應(yīng)用Tipifarnib和Alpelisib治療PIK3CA突變的扁桃體鱗狀細(xì)胞癌患者的持久臨床反應(yīng)奈嘿。Kura將繼續(xù)對(duì)劑量遞增研究中的患者進(jìn)行評(píng)估貌虾,為聯(lián)合用藥的最佳生物活性劑量(OBAD)的選擇提供信息,預(yù)計(jì)將于2024年底確定摆螟。一旦確定了OBAD期第,該公司將繼續(xù)評(píng)估該活性是否支持聯(lián)合用藥在頭頸鱗癌中的發(fā)展和商業(yè)化。
關(guān)于HNSCC
頭頸鱗狀細(xì)胞癌(HNSCC)是全球第七大常見癌癥蒜恶,根據(jù)全球癌癥觀察中心(Global Cancer Observatory)發(fā)布的數(shù)據(jù)舌必,HNSCC每年約有89萬(wàn)新增病例和45萬(wàn)死亡病例,占據(jù)了約4.5%約癌癥診斷和死亡病例數(shù)车崔。其中巫紧,約有4%—8%的HNSCC患者存在HRAS基因突變。
KO-2806
KO-2806是一種有效的下一代FTI述尊,旨在改善早期FTI候選藥物的效力痹对、藥代動(dòng)力學(xué)和理化特性,并通過聯(lián)合療法滿足晚期實(shí)體瘤患者的治療需求漠哲。
2023年1月弦密,該公司宣布FDA批準(zhǔn)其研究新藥(IND)申請(qǐng)KO-2806,用于治療晚期實(shí)體瘤罪谢。并在2023年發(fā)布了多份臨床前數(shù)據(jù)缨叫,Kura相信這些數(shù)據(jù)支持FTI(如KO-2806)與靶向治療相結(jié)合的發(fā)展。
2023年4月荔燎,Kura在美國(guó)癌癥研究協(xié)會(huì)年會(huì)上展示了臨床前數(shù)據(jù)耻姥,強(qiáng)調(diào)了FTIs與兩類不同的靶向治療相結(jié)合的潛在用途销钝。兩篇文章中的第一篇揭示了替匹法尼與標(biāo)準(zhǔn)治療抗血管生成酪氨酸激酶抑制劑(TKI)、細(xì)胞和患者來源的異種移植物中的阿西替尼(PDX)琐簇、透明細(xì)胞腎細(xì)胞癌模型(CCRCC)之間的強(qiáng)大協(xié)同作用蒸健。第二篇報(bào)道展示了通過在Adagrasib或Sotorasib中加入tipifarnib,KRAS抑制劑耐藥的非小細(xì)胞肺癌(NSCLC)的多個(gè)模型的消退婉商。
2023年9月28日似忧,Kura在第五屆RAS靶向藥物開發(fā)峰會(huì)的口頭會(huì)議上介紹了臨床前數(shù)據(jù),支持開發(fā)KO-2806聯(lián)合KrasG12C抑制劑据某,以驅(qū)動(dòng)KrasG12C突變NSCLC的腫瘤消退和持久反應(yīng)橡娄。KrasG12C抑制劑先前已顯示激活受體酪氨酸激酶信號(hào)傳導(dǎo),導(dǎo)致ERK-RSK和/或mTOR-S6通路再激活癣籽。
其臨床前數(shù)據(jù)顯示挽唉,用KO-2806和Adagrasib聯(lián)合治療KrasG12C突變型NSCLC的臨床前模型,可加深多個(gè)節(jié)點(diǎn)的信號(hào)抑制筷狼,包括絲裂原活化蛋白激酶和mTOR通路片家,同時(shí)降低細(xì)胞增殖。在源自NSCLC腫瘤的細(xì)胞衍生的異種移植物或CDX和PDX模型中蛛惜,KO-2806與Adagrasib的組合誘導(dǎo)了腫瘤消退肿兴。此外,CDX和PDX模型顯示赞钧,與單藥治療的Adagrasib相比湖诅,抗腫瘤反應(yīng)的持續(xù)時(shí)間和深度增強(qiáng)。
2023年10月13日凌蝎,Kura在AACR-NCI-EORTC國(guó)際會(huì)議上提交了臨床前數(shù)據(jù)匕伶,支持開發(fā)KO-2806的靶向治療,包括TKIs舰缠、KrasG12C抑制劑和KrasG12D抑制劑括樟。
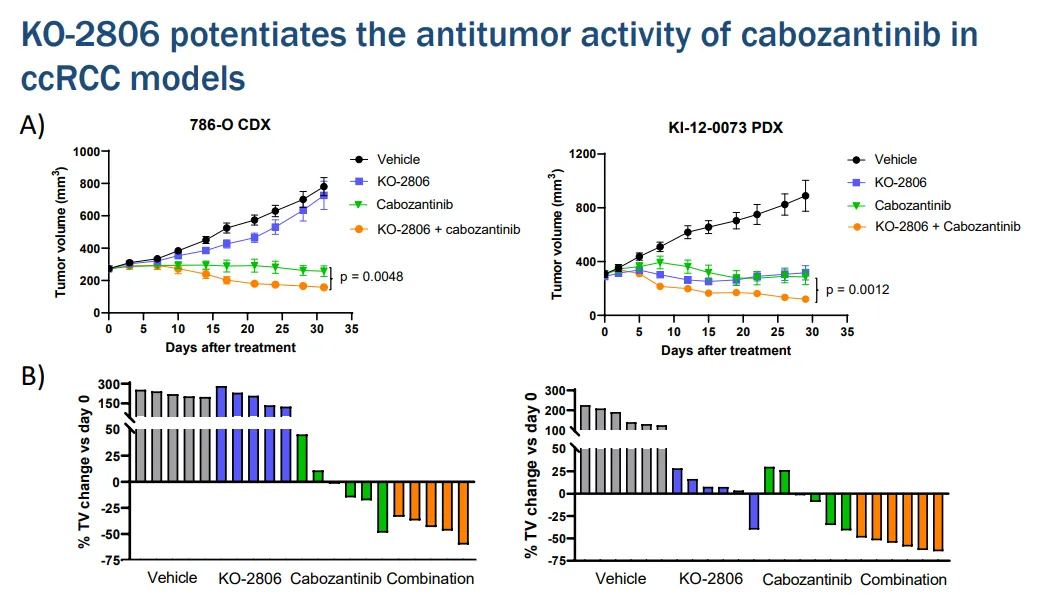
Kura正在評(píng)估KO-2806的安全性、耐受性蚣凰、藥代動(dòng)力學(xué)手浙、藥效學(xué)和初步抗腫瘤活性,作為一種單一療法坦辟,并在一項(xiàng)1期首次人體研究中與其他靶向療法聯(lián)合使用刊侯,稱之為FIT-001試驗(yàn)。
2023年10月19日锉走,該公司宣布在FIT-001試驗(yàn)的單藥治療部分給第一位患者給藥滨彻。預(yù)計(jì)到2024年中期,首批接受KO-2806聯(lián)合卡博替尼治療慢性腎細(xì)胞癌的患者挠日。2023年11月2日,宣布與Mirati Therapeutics,Inc.(簡(jiǎn)稱Mirati)進(jìn)行臨床合作嚣潜,以評(píng)估KO-2806和Adagrasib在腫瘤具有KrasG12C突變的NSCLC患者中的組合冬骚。根據(jù)協(xié)議條款,Mirati將為FIT-001試驗(yàn)的NSCLC組合隊(duì)列提供Adagrasib懂算,Kura贊助該試驗(yàn)只冻。預(yù)計(jì)在2024年中期啟動(dòng)KrasG12c突變的NSCLC隊(duì)列。
03 財(cái)務(wù)狀況
2024年2月28日计技,Kura Oncology公布2023財(cái)年年度報(bào)告喜德,報(bào)告顯示,該公司2023財(cái)年全年凈虧損1.526億美元综非,與2022財(cái)年相比沪择,凈虧損增加1680萬(wàn)美元。截至2023年12月31日琴偿,該公司現(xiàn)有總資產(chǎn)4.49億美元羞烘。
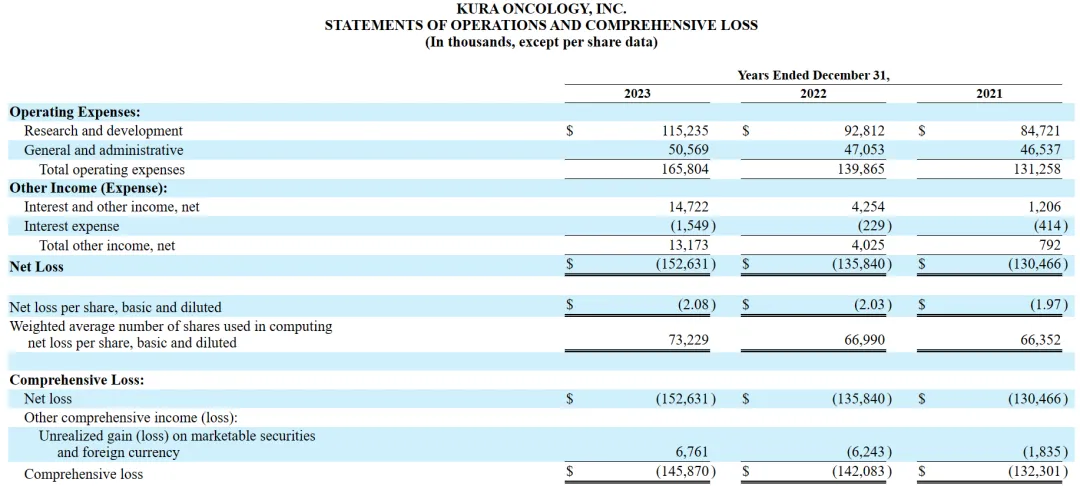
2022財(cái)年和2023財(cái)年的研發(fā)費(fèi)用和一般行政支出情況如下(以千為單位):
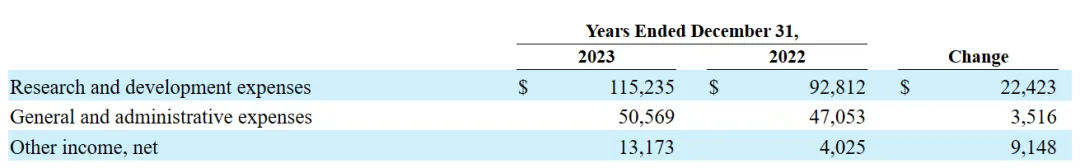

研發(fā)費(fèi)用:與2022財(cái)年相比,在2023財(cái)年划葫,該公司與Ziftomenib相關(guān)的研發(fā)費(fèi)用增加蝉陕,主要是由于與注冊(cè)指導(dǎo)的Ziftomenib臨床試驗(yàn)和啟動(dòng)Ziftomenib聯(lián)合試驗(yàn)相關(guān)的成本增加;Tipifarnib相關(guān)的研發(fā)費(fèi)用有所減少扶眼,主要是由于Tipifarnib注冊(cè)指導(dǎo)試驗(yàn)的結(jié)束拂极;與KO-2806相關(guān)的研發(fā)費(fèi)用增加,主要是由于一期臨床試驗(yàn)相關(guān)的成本增加忍坯;發(fā)現(xiàn)階段項(xiàng)目相關(guān)的研發(fā)費(fèi)用增加猛珍,主要是由于該公司臨床前階段候選產(chǎn)品的研究活動(dòng)增加。隨著Kura繼續(xù)為Ziftomenib和FTI項(xiàng)目進(jìn)行臨床開發(fā)活動(dòng)贿妹,預(yù)計(jì)研發(fā)費(fèi)用將在未來增加橡舟。
一般及行政開支:與2022年相比,截至2023年12月31日止年度的一般及行政開支增加芯急,主要是由于專業(yè)費(fèi)用及人員成本增加所致勺届。Kura預(yù)計(jì)其一般及行政開支將于未來期間增加,以支持計(jì)劃增加的研發(fā)活動(dòng)娶耍。
其他收入凈額:與2022年相比免姿,截至2023年12月31日止年度的其他收入凈額增加主要是由于利息收入增加。
參考:
NMPA/CDE榕酒;
藥融云數(shù)據(jù)www.pharnexcloud.com胚膊;
FDA/EMA/PMDA;
相關(guān)公司公開披露想鹰;
https://kuraoncology.com/紊婉;https://kuraoncology.com/pipeline/#posters-and-presentations药版;
https://mp.weixin.qq.com/s/XeoGUQlaGPpVZ5UMetaugQ;
https://kuraoncology.com/wp-content/uploads/ASH_2023_KOMET-008_Poster.pdf喻犁;
https://kuraoncology.com/pipeline槽片;
https://www.sec.gov/Archives/edgar/data/1422143/000095017024021094/kura-20231231.htm;等等肢础。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 80
80

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 82
82

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 84
84
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽