
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 醫(yī)藥魔方
醫(yī)藥魔方  2024-05-15
2024-05-15
 405
405
新的行業(yè)周期下壶辜,創(chuàng)新藥企的競爭比拼進入下半場尼软。原來圍繞靶點賽道抚袁、技術(shù)平臺展開的研發(fā)競賽法則不再完全適用,業(yè)界對企業(yè)的商業(yè)化撕拇、BD和國際化能力等有了更高的期待痪酸。
盡管如此,競爭的內(nèi)核并沒有改變豌熄,與時俱進的差異化能力仍是制勝關(guān)鍵授嘀。每家創(chuàng)新藥企都會將打造差異化奉為生存策略,但現(xiàn)實情況是锣险,泡沫迷人眼蹄皱,真正有遠見的開拓者不多。
康諾亞成立芯肤、壯大的故事巷折,或可作為biotech追求差異化的一個代表性案例压鉴。在腫瘤免疫療法如日中天的2016年,兩位國內(nèi)外腫瘤免疫的先驅(qū)者陳博和王常玉卻毅然轉(zhuǎn)身锻拘,選擇了一條從零開始的道路油吭,創(chuàng)立了康諾亞,切入了當時國內(nèi)比較被忽視的自免領(lǐng)域署拟。
如今婉宰,越來越多的國內(nèi)藥企搶灘布局自免領(lǐng)域,而康諾亞已在這片藍和魄睿卡住身位心包。司普奇拜單抗在優(yōu)先審評的加速下有望于今年獲批上市,成為首個國產(chǎn)酵抚、全球范圍內(nèi)第二家上市的IL-4Rα單抗辛辱。
從1到10的路上,康諾亞還有更多的底牌凹田,涵蓋雙抗找仙、ADC和小核酸藥物等新模態(tài)糜谒,而且其臨床開發(fā)進度幾乎都處于國內(nèi)甚至全球前三的位置链坝。
康諾亞進度領(lǐng)先的部分臨床管線
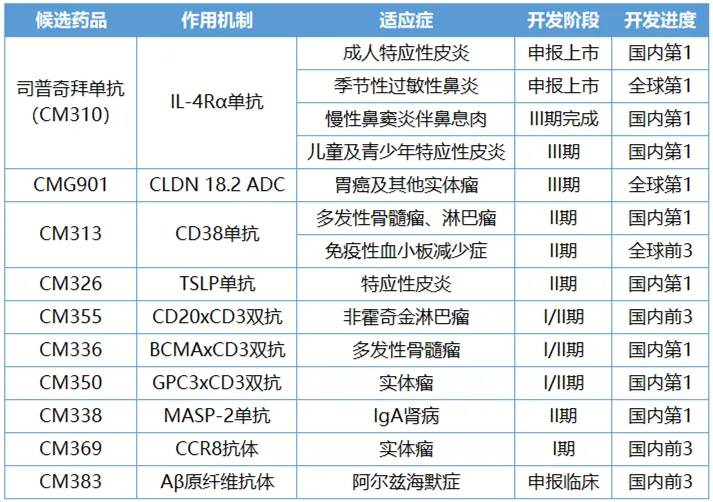
有序擴張研發(fā)體系的同時,康諾亞的能力也在全面進化狸岁。BD碩果累累饿婴,過半臨床管線實現(xiàn)對外授權(quán);商業(yè)化層面泛滔,康諾亞秣馬厲兵腌馒,正在組建一支精銳團隊;內(nèi)部規(guī)墓鸦ǎ化生產(chǎn)能力也已到位掐划。悄然間,biopharma的雛形已現(xiàn)昼钻。
出手即“王炸”
當行業(yè)進入周期調(diào)整掸屡,泡沫破裂后的競爭越發(fā)殘酷。也恰恰是這樣充滿變化的洗牌時刻然评,實力派玩家越容易出線仅财,真正具有含金量的產(chǎn)品越能凸顯其價值。
康諾亞即將打出第一張王牌碗淌。司普奇拜單抗已于2023年底申報上市盏求,擬用于治療成人中重度特應性皮炎。
選擇IL-4Rα賽道不是偶然亿眠∷榉#康諾亞成立之際磅废,自免領(lǐng)域最暢銷的產(chǎn)品修美樂已經(jīng)上市十多年,盤踞藥王寶座荆烈。如果再去切入TNF-α賽道还蹲,或為時已晚。即使避開了最熱門也是同質(zhì)化最嚴重的賽道耙考,要從數(shù)不勝數(shù)的靶點中挖掘出優(yōu)質(zhì)標的谜喊,難度亦不小⊥醴疲康諾亞聯(lián)合創(chuàng)始人巨陌、臨床前評估及轉(zhuǎn)化研究負責人王常玉學免疫出身,對靶點和疾病的作用機制有著深入了解羽矮。
“早期自免領(lǐng)域的藥主要用于治療1型炎癥巡抛,針對2型炎癥當時新藥很少,而過敏性疾病基本都屬于2型痪蚤,市場很大追艘。”王常玉從源頭分析道穴肄,在2型炎癥即Th2通路中娇符,IL-4Rα占據(jù)核心位置,既影響Th2細胞分化人度,又控制IL-4及IL-13信號傳導遂撮,調(diào)節(jié)IgE過敏性抗體轉(zhuǎn)換。
機制的重要性賦予了司普奇拜單抗廣泛治療過敏性疾病的可能性拉氧,康諾亞率先瞄準患者基數(shù)極其龐大壳坪、臨床需求迫切的中重度特應性皮炎這一疾病領(lǐng)域。
據(jù)調(diào)查掰烟,2020年中國中重度特應性皮炎患者人數(shù)達1870萬爽蝴,而且患病率逐年上升,到2025年患者群體將擴大至2090萬左右[1]纫骑。目前蝎亚,在中國獲批治療特應性皮炎的生物制劑僅有進口的度普利尤單抗。
從非頭對頭數(shù)據(jù)來看惧磺,司普奇拜單抗治療中重度特應性皮炎的療效不輸于度普利尤單抗颖对。III期數(shù)據(jù)顯示,治療16周時磨隘,67%的司普奇拜單抗組患者實現(xiàn)濕疹面積和嚴重程度指數(shù)較基線改善至少75%(EASI-75)[2]缤底。而III期SOLO 1研究顯示,接受度普利尤單抗治療16周番捂,51%的患者實現(xiàn)EASI-75[3]个唧。
至于更長期的52周數(shù)據(jù)江解,或?qū)⒑芸煺脚丁M醭S耠y掩期待徙歼,他表示:“結(jié)果比我們想象的還要好废筒。”
之所以能取得不錯的臨床獲益捆牍,離不開康諾亞在抗體設(shè)計和篩選上積攢的優(yōu)勢棉挤。有跨國公司比賽諾菲更早啟動了IL-4Rα單抗的臨床試驗,結(jié)果卻不夠理想跃躯。王常玉指出主要原因在于生物活性不夠強岳扒,這是評價抗體藥物質(zhì)量的一個關(guān)鍵指標∥ň茫“我們有幾十年的深耕經(jīng)驗掘叫,在生物活性評估方面做得特別完全和深入。我們的抗體都通過多個不同的assay檢測吕罩,確保其具備best-in-class(BIC)潛力洒屡。”
一款產(chǎn)品的成色質(zhì)地究竟如何等跳,最終要交由市場檢驗查奉。Biotech的商業(yè)化能力天生薄弱,為此康諾亞下了一番苦功井辜,在3年前就開始籌謀鋪路绎谦。開展臨床試驗時,康諾亞優(yōu)先覆蓋大三甲機構(gòu)粥脚,希望通過優(yōu)先覆蓋頭部核心醫(yī)院,實現(xiàn)上市后產(chǎn)品的快速放量包个。商業(yè)化團隊正迅速壯大刷允,涵蓋市場、醫(yī)學碧囊、準入树灶、銷售、商務等核心部門糯而。
以成人中重度特應性皮炎為首發(fā)適應癥天通,只是司普奇拜單抗打入市場的第一步。今年上半年熄驼,康諾亞已啟動了12歲以上青少年特應性皮炎的III期臨床像寒,針對6歲及以上兒童的臨床研究也在規(guī)劃中。
司普奇拜單抗III期臨床試驗開展情況
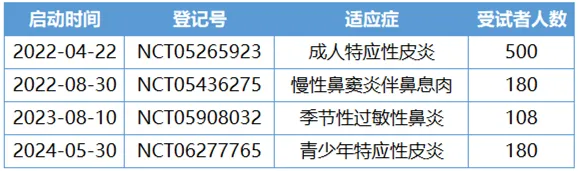
* 數(shù)據(jù)來自clinicaltrials.gov網(wǎng)站登記信息
此外瓜贾,治療慢性鼻竇炎伴鼻息肉的III期研究也已告捷会贝,康諾亞計劃于今年遞交這一適應癥的上市申請苞誊。該適應癥此前的II期研究結(jié)果亮眼,研究顯示跺鬼,司普奇拜單抗治療16周后可使鼻息肉顯著縮小盘贤,鼻堵癥狀顯著緩解,從而顯著提高患者的生活質(zhì)量墩沸,這一研究結(jié)果去年發(fā)表在了《Lancet》子刊《eClinicalMedicine》上蚣枝。未來,這項適應癥或?qū)⒊蔀樗酒掌姘輪慰狗帕康牧硪煌黄瓶凇?
“司普奇拜單抗的治療潛力很大址嘴,我們一步一步來覆首,先把臨床需求迫切的適應癥拿下。畢竟康諾亞還是biotech伴罢,不可能一口就吃成個胖子亦蟋。”
探尋突圍路徑
在從1到10的路上挚性,康諾亞聚焦自免和腫瘤雙賽道不斷蓄力纲盟,差異化管線格局漸漸形成。
CM313是中國首款獲批臨床的國產(chǎn)CD38單抗烫扼,目前推進至II期臨床階段曙求。全球范圍內(nèi)有強生的達雷妥尤單抗和賽諾菲的艾沙妥昔單抗兩款CD38單抗上市,獲批適應癥集中于多發(fā)性骨髓瘤(MM)映企。
康諾亞采取的策略是悟狱,布局血液瘤相關(guān)適應癥的同時,積極探索從系統(tǒng)性紅斑狼瘡和免疫性血小板減少癥等嚴重自免疾病突圍的路徑堰氓。
回歸靶點特性挤渐,CM313的確有潛力實現(xiàn)腫瘤和自免“跨界”治療∷酰“MM的發(fā)病機制與漿細胞增殖密切相關(guān)浴麻,而CD38在漿細胞高表達。作為清除性抗體囤攀,CM313可以殺傷包括MM在內(nèi)的漿細胞腫瘤软免。”王常玉繼續(xù)解釋道:“很多自免疾病由自身抗體引起焚挠,而大部分抗體由漿細胞產(chǎn)生膏萧。針對這些自免疾病,CM313通過清除漿細胞相當于清除疾病根源挖毅,達到治療目的尤稍。”
一項研究者發(fā)起的芒浪、評價CM313治療成年人原發(fā)免疫性血小板減少癥的臨床研究數(shù)據(jù)去年在第65屆美國血液協(xié)會(ASH)年會上以墻報形式發(fā)布歧余,研究顯示氢滋,21例入組患者中,7例受試者完成了8次治療跟努,隨訪期至少為8周价忙。7例患者中,100.0%(7/7)在首次給藥后8周內(nèi)達到血小板計數(shù)≥50×10^9/L垛撬,中位值緩解時間為1周(范圍1-3)皮围。這一結(jié)果展示了除骨髓瘤、淋巴瘤治療外达快,CM313在原發(fā)免疫性血小板減少癥這類自身免疫性疾病中的治療潛力捏裂。
立足于抗體發(fā)現(xiàn)平臺,康諾亞還開發(fā)了TSLP單抗CM326和MASP2單抗CM338甸胃,讓自免產(chǎn)品管線進一步擴充吩屹。在腫瘤領(lǐng)域,多款雙抗和ADC藥物嶄露頭角拧抖。
CM336煤搜、CM350和CM355都屬于CD3雙抗,分別與不同靶點組合用于不同的腫瘤適應癥唧席。其中擦盾,BCMA/CD3雙抗CM336和CD3/CD20雙抗CM355用于血液瘤,細分適應癥有所差別淌哟。CM336主攻MM迹卢,CM355針對淋巴瘤。
這樣的布局也體現(xiàn)了康諾亞戰(zhàn)略上的深思熟慮徒仓。CD3雙抗臨床上有可能覆蓋和替代CAR-T治療的血液瘤疾病范圍腐碱,而且CD3雙抗不需要體外細胞培養(yǎng),比CAR-T的治療流程更簡單方便蓬衡,成本較低喻杈。
“與同類產(chǎn)品相比,我們的CD3雙抗可能是BIC狰晚。”既往CD3雙抗治療常會出現(xiàn)細胞因子風暴(CRS)嚴重副作用须彼。通過結(jié)構(gòu)優(yōu)化乒萝,研發(fā)團隊保證其在最大限度激活T細胞殺傷作用時,盡量減少CRS司箫∠朐ぃ“我們的雙抗是天然的IgG分子結(jié)構(gòu),穩(wěn)定性绕众、成藥性瞪卜、藥代活性都很好肴摊。”
王常玉直言畴文,不少CD3雙抗平臺用的是非天然結(jié)構(gòu)碉晾,增加單鏈或納米抗體,成藥性差删猿÷埃康諾亞則選擇了天然抗體結(jié)構(gòu),這也是影響雙抗穩(wěn)定性和成藥性的關(guān)鍵隅本∈涤蓿“體內(nèi)抗體經(jīng)過上億年進化已經(jīng)是一個最佳的選擇。并不是說做所謂比較新的東西兔辅,就會比天然的更好腊敲。”
雙抗治療實體瘤也是大勢所趨维苔,GPC3/CD3雙抗CM350一樣承載著康諾亞的希望——填補國內(nèi)肝癌治療未盡之需碰辅。國內(nèi)每年新增30-40萬肝癌病例,仍缺乏有效治療手段蕉鸳。GPC3是治療肝癌的理想靶點乎赴,約在75%的肝癌中觀察到GPC3高表達[4]。
“不僅是走別人已經(jīng)走過的路潮尝,我們還想探索一些比較前沿的方向榕吼。”GPC3尚未成藥勉失,背后存在不確定性也蘊藏著較大的機遇羹蚣。目前,康諾亞領(lǐng)跑GPC3/CD3雙抗的開發(fā)乱凿,有望向first-in-class發(fā)起沖擊忘当。
當下火熱的ADC賽道,康諾亞從2017年便開始籌謀布局帝璃,潛在世界首創(chuàng)靶向CLDN18.2 的ADC藥物CMG901就是答卷圈蛹。
王常玉告訴我們,在CLDN18.2靶點的開發(fā)上茎陪,康諾亞一開始就沒有把單抗作為終點奇茫,而是一步到位打造成ADC。近期烫王,安斯泰來的CLDN18.2單抗zolbetuximab在日本獲批上市上绅,但其單藥治療效果有限,日本厚生勞動省批準的方案也是與化療聯(lián)用〉合康諾亞的遠見無需多言任汪。
值得一提的是,CMG901僅用中國臨床數(shù)據(jù)就率先獲得了CDE突破性治療藥物認定和美國FDA快速通道資格滚吱,成為目前國內(nèi)唯一獲突破性治療藥物認定的CLDN18.2靶向療法枷窿。CMG901被業(yè)界看好,在去年以近12億美金的總額將全球權(quán)益授權(quán)給了阿斯利康蓄氧,阿斯利康會全額出資推動后續(xù)研發(fā)函似,這無疑將繼續(xù)提速藥品的開發(fā)進度。如今喉童,在阿斯利康的保駕護航下撇寞,CMG901/AZD0901已快速推進到全球III期臨床。
以開發(fā)CMG901為基礎(chǔ)堂氯,康諾亞也在不斷打造和豐富自身的ADC技術(shù)和產(chǎn)品管線蔑担,幾個新的ADC藥物可能在今年申報臨床。
小核酸藥物也是康諾亞未來的發(fā)力點咽白∑∥眨“大部分抗體靶點位于細胞膜,而小核酸藥物可深入到細胞里晶框,兩者互補排抬。”除開發(fā)常規(guī)的小核酸藥物外授段,康諾亞還將探索抗體偶聯(lián)小核酸(AOC)新模態(tài)蹲蒲,以突破肝靶向遞送的限制∏暮“如果能夠利用抗體靶向特定的細胞或靶點牲羊,我們會比純粹做小核酸藥物的公司有更多的優(yōu)勢∩蕉ィ”
永遠像biotech一樣前行
“我們要緊跟行業(yè)發(fā)展的方向蛮血,不能固步自封。不能因為自己抗體做得好就一直停留在抗體上好员,慢慢地可能就被淘汰了芽刨,所以我們在不斷學習新技術(shù)÷猿荆”
從單抗殷感,到雙抗、ADC感戴,再到小核酸藥物,康諾亞與時俱進地升級和擴張技術(shù)平臺赵腰,主動拔高自身競爭門檻都癣。切入新的技術(shù)賽道谐歪,康諾亞自帶優(yōu)勢。不同賽道間看似跨度很大瓶逃,實質(zhì)上或多或少都可以與抗體關(guān)聯(lián)束铭。
在拓展疾病領(lǐng)域時,康諾亞也充分施展所長進行布局厢绝。Aβ原纖維抗體CM383已申報臨床契沫,嘗試攻克“研發(fā)死亡谷”阿爾茲海默癥領(lǐng)域。此前昔汉,有魄力且有能力將自研Aβ單抗推進臨床的國內(nèi)藥企僅恒瑞一家懈万。而在抗體研發(fā)方面的經(jīng)驗優(yōu)勢,構(gòu)成了康諾亞挺進阿爾茲海默癥領(lǐng)域的最大底氣靶病。
與早期批準上市的Aduhelm清除所有Aβ蛋白不同会通,CM383特異性清除病理性的Aβ聚集體。通過延長半衰期娄周,CM383有可能實現(xiàn)比Leqembi更低的給藥頻率涕侈。
身處瞬息萬變的研發(fā)競賽中,速度和效率對于企業(yè)來說也至關(guān)重要煤辨。隨著新藥生命周期的縮短裳涛,同靶點開發(fā)可能只有爭取市場前三,才有足夠競爭力侥锨。而康諾亞的臨床管線的開發(fā)進度幾乎都處于國內(nèi)甚至全球前三的位置念焙。
“藥物開發(fā)很大程度上依賴于經(jīng)驗積累。我們的研發(fā)經(jīng)驗和知識面比較足逐茄,所以相對來講做得比較快剑碌。”王常玉說道:“這與leadership也有一定的關(guān)系张域,組織架構(gòu)和決策能力都是綜合考量因素孟溯。”康諾亞CEO陳博曾多次創(chuàng)業(yè)蚪录,既是成功的科學家呜款,也擅長從0到1的開拓和公司管理,自上而下使團隊以結(jié)果為導向快速推進工作粤街。
康諾亞的能力正在全面進化剩症。BD碩果累累,過半臨床管線實現(xiàn)對外授權(quán)职颜。在合作權(quán)益上胞饭,康諾亞進行了靈活取舍,比如選擇將CM310和CM326呼吸適應癥授權(quán)給在該領(lǐng)域有豐富資源和經(jīng)驗的石藥集團,但基于市場和自身優(yōu)勢洞察躬它,保留了特應性皮炎和鼻炎等適應癥腾啥。在現(xiàn)金為王的行業(yè)低谷期,多筆BD交易實實在在帶來了增量資金冯吓。
當然倘待,如果想要在行業(yè)里走得更遠,過分依賴BD不是長久之計组贺,biotech向上的優(yōu)選通道還是通過產(chǎn)品銷售實現(xiàn)自我輸血凸舵。
之于康諾亞而言,2024是關(guān)鍵一年失尖。以司普奇拜單抗為起點啊奄,康諾亞將踏上全新的商業(yè)化征程。內(nèi)部規(guī)谋⒎拢化生產(chǎn)能力已到位增热,成都生產(chǎn)基地可提供18,600L生物藥產(chǎn)能,可同時滿足5-15個抗體藥物進行商業(yè)化生產(chǎn)胧辽,biopharma的雛形已現(xiàn)嗤矾。
“不管從產(chǎn)品、市值還是影響力方面悄锈,康諾亞現(xiàn)在都有了一定的基礎(chǔ)拒牡,但我們還是永遠把自己當做一個biotech,不斷學習菌渐,不斷前進随去。”
參考資料
[1] 康諾亞招股書
[2] Zhang J et al. 2023 EADV poster P0414: Efficacy and Safety of Stapokibart (CM310) in Adults with Moderate-to-Severe Atopic Dermatitis: Results of A Randomized, Double-Blind, Placebo-Controlled Phase 3 Trial
[3] Simpson EL, Bieber T, Guttman‐Yassky E, et al. Two phase 3 trials of dupilumab versus placebo in atopic dermatitis [J]. N Engl J Med, 2016, 375(24): 2335‐2348.
[4] Fanching Lin, Renee Clift, Takeru Ehara, et al. Novel GPC3-targeting radiopharmaceutical therapy for hepatocellular carcinoma [J]. Hepatobiliary Cancer, 2024.

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍觀
深藍觀  2024-11-28
2024-11-28
 79
79

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 81
81

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 83
83