
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥明康德
藥明康德  2024-05-17
2024-05-17
 508
508
今日,美國FDA宣布,加速批準安進(Amgen)公司開發(fā)的雙特異性T細胞結(jié)合器(BiTE)Imdelltra(tarlatamab)上市麦咪,用于治療廣泛期小細胞肺癌(ES-SCLC)成人患者蜕煌。他們在接受化療時或之后出現(xiàn)疾病進展石被。此前安進的新聞稿指出汁眶,Imdelltra是首款用于治療實體瘤的獲批BiTE療法。
Tarlatamab的批準是基于一項全球性2期臨床試驗DeLLphi-301的結(jié)果遮店。試驗結(jié)果顯示捻境,tarlatamab在含鉑化療期間或之后疾病進展的晚期SCLC患者中具有持久的抗腫瘤活性。去年發(fā)布在《新英格蘭醫(yī)學(xué)雜志》(NEJM)上的數(shù)據(jù)顯示戳酒,中位隨訪時間為10.6個月時炸鹅,包含100例接受選定10 mg劑量tarlatamab治療患者的意向治療分析顯示客觀緩解率(ORR)為40%(97.5% CI:29,52)伟杂。這一患者群體的中位無進展生存期(mPFS)為4.9個月(95% CI:2.9肮渣,6.7),中位總生存期為14.3個月(95% CI:10.8名挪,NE)蓉庆。在對10 mg劑量tarlatamab治療產(chǎn)生應(yīng)答的患者中,58%的患者在數(shù)據(jù)截止時維持應(yīng)答至少6個月糜透。
安全性方面,與1期臨床試驗相比臭杰,未觀察到新的安全性信號粤咪。因治療相關(guān)不良事件(TRAE)導(dǎo)致的停藥不常見(4%)。10 mg tarlatamab組患者報告的最常見的治療伴發(fā)不良事件(TEAE)為細胞因子釋放綜合征(CRS渴杆;49%)寥枝、發(fā)熱(38%)、食欲下降(25%)和味覺障礙(24%)磁奖。CRS主要限于第1次和第2次給藥囊拜,主要為1級或2級,通潮却睿可通過支持治療進行控制冠跷。在10 mg tarlatamab劑量組中,3級CRS發(fā)生率較低(0%)身诺,未觀察到3級免疫效應(yīng)細胞相關(guān)神經(jīng)毒性綜合征(ICANS)和相關(guān)神經(jīng)系統(tǒng)事件(0%)蜜托。NEJM論文報告1名患者死亡,被認為與治療相關(guān)。
Tarlatamab是安進研究人員設(shè)計的一種靶向雙特異性抗體(bsAbs)橄务,通過同時結(jié)合T細胞上的CD3和SCLC細胞上的DLL3幔托,使患者自身的T細胞與SCLC細胞非常接近。這導(dǎo)致了免疫突觸的形成和癌細胞的裂解王庐。DLL3是治療SCLC一個令人興奮的靶點细周,因為大約85%到94%的SCLC患者的癌細胞表面表達DLL3,它在正常細胞中表達極少毫例。安進公司計劃啟動兩項3期臨床試驗谒酌,分別檢驗tarlatamab作為一線療法,治療ES-SCLC惑箕,以及治療局限期小細胞肺癌(LS-SCLC)的效果祸芙。
SCLC是侵襲性最強的實體瘤之一,患者在接受一線治療后中位總生存期只有大約12個月科谨,5年生存率大約7%钱锉。僅在美國,每年就有約3.5萬名SCLC患者確診渊喘。
雙特異性抗體具備兩個不同的抗原結(jié)合域诊捆,能夠同時與兩種不同的抗原或同一抗原的兩個不同表位結(jié)合。這種獨特的結(jié)構(gòu)使得bsAbs能夠同時針對多個靶點或表位拨才,激發(fā)一系列的生理或抗腫瘤反應(yīng)纸措,這些反應(yīng)既可以是相互獨立的,也可能是相互關(guān)聯(lián)的官脓。這類療法類似于由兩種單克隆抗體混合而成的“雞尾酒”协怒,但對藥物開發(fā)人員來說,他們只需開發(fā)一種分子卑笨,而患者也可能只需接受一種治療就能取得預(yù)期的療效孕暇。更重要的是,bsAbs的協(xié)同作用可能會帶來更加顯著的治療效果赤兴。
▲處于臨床開發(fā)階段的雙特異性抗體在癌癥治療中的應(yīng)用(圖片來源:參考資料[4])
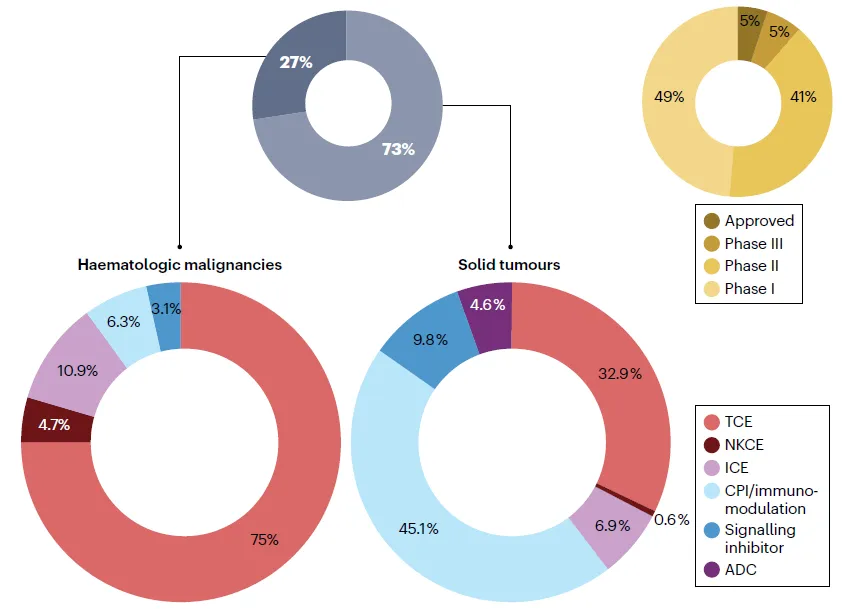
據(jù)統(tǒng)計妖滔,目前有200多種bsAbs在超過300個臨床試驗中進行評估,其中約73%的試驗針對實體瘤桶良,另外27%旨在治療血液惡性腫瘤座舍。值得一提的是,目前大約有50%處于臨床開發(fā)階段的bsAbs已經(jīng)進入了后期階段(2期和3期)或者已經(jīng)獲得批準陨帆。從作用機制來看曲秉,治療實體瘤的bsAbs主要為免疫調(diào)節(jié)劑,其中包括雙特異性免疫檢查點抑制劑(CPIs疲牵,約45%)和雙特異性T細胞結(jié)合器(約33%)岸浑,其次是針對雙重信號通路的bsAbs搏存、免疫細胞結(jié)合器(ICEs)和雙特異性抗體偶聯(lián)藥物(ADCs)。而在治療血液惡性腫瘤方面慷郎,雙特異性T細胞結(jié)合器占主導(dǎo)地位(約75%)啡产,其次是ICEs、雙CPIs和自然殺傷細胞結(jié)合器(NKCEs)促驶。
參考資料:
[1] Imdelltra label. Retrieved May 16, 2024, from https://www.accessdata.fda.gov/drugsatfda_docs/label/2024/761344s000lbl.pdf
[2] F.D.A. Approves Drug for Persistently Deadly Form of Lung Cancer. Retrieved May 16, 2024, from https://www.nytimes.com/2024/05/16/health/fda-amgen-small-cell-lung-cancer-imdelltra.html
[3] FDA Grants Priority Review to Amgen's Tarlatamab Application for Advanced Small Cell Lung Cancer. Retrieved May 16, 2024, from https://www.prnewswire.com/news-releases/fda-grants-priority-review-to-amgens-tarlatamab-application-for-advanced-small-cell-lung-cancer-302014639.html
[4] Klein, C., Brinkmann, U., Reichert, J.M. et al. The present and future of bispecific antibodies for cancer therapy. Nat Rev Drug Discov (2024). https://doi.org/10.1038/s41573-024-00896-6

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍觀
深藍觀  2024-11-28
2024-11-28
 77
77

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 80
80

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 82
82