
 研發(fā)追蹤
研發(fā)追蹤
 藥渡Daily
藥渡Daily  2024-05-20
2024-05-20
 1138
1138
今日(2024年5月15日)哺哼,從衛(wèi)材官方公布信息可知缸托,衛(wèi)材已開始向FDA滾動提交用于每周維持劑量的Lecanemab-irmb(商品名:LEQEMBI?)皮下注射劑的生物制品許可申請(BLA)(FDA授予快速通道指定)亏吝。LEQEMBI適用于治療輕度認知障礙(MCI)或輕度癡呆階段(早期AD)的阿爾茨海默财恪(AD)患者紫侵。

本次BLA是基于Clarity AD(301研究)開放標簽擴展研究(OLE)的數(shù)據(jù)和觀察數(shù)據(jù)模型。Leqembi是一種皮下自動注射器殃描,本次獲批之后峰礁,可用于在家中或醫(yī)療機構注射,對于已完成兩周靜脈注射起始階段的患者將接受每周360mg皮下注射劑量问嬉,以維持有效的藥物濃度碱暗。
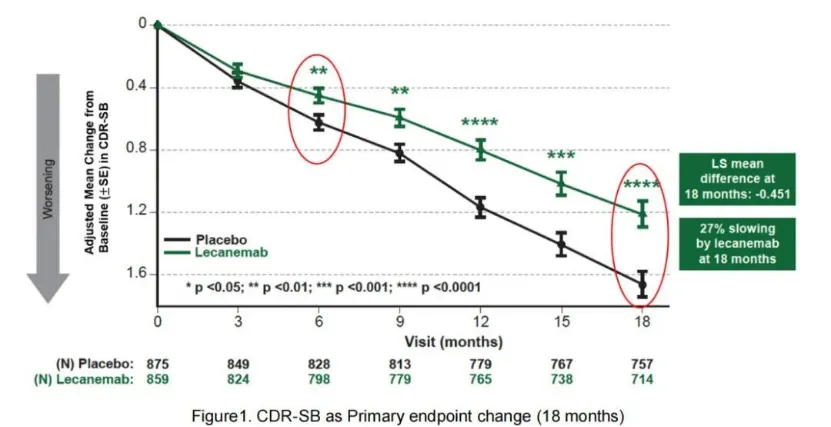
Lecanemab臨床III期研究Clarity AD確認了臨床獲益:Clarity AD III期臨床達到了降低CDR-SB評分主要臨床終點和所有關鍵次要臨床終點。在治療18個月之后炮姑,在ITT人群中杖户,Lecanemab相比安慰劑降低了27%的CDR-SB評分(降低了0.45分,p=0.00005)骡尽。
從藥渡數(shù)據(jù)檢索可知遣妥,Lecanemab注射劑于2022年1月6日獲得FDA的加速批準,用于治療輕度認知障礙或輕度癡呆階段的AD患者攀细;2023年6月10日箫踩,F(xiàn)DA外周和中樞神經系統(tǒng)藥物咨詢委員會專家以6:0的投票結果支持Lecanemab獲得完全批準;2023年7月6日谭贪,Lecanemab成為首個獲得FDA完全批準的抗Aβ單抗境钟。
2024年Q1,Lecanemab銷售收入為1900萬美元俭识,較2023年第四季度700萬美元的收入增長了近三倍慨削。自2023年底以來,目前使用Lecanemab的患者人數(shù)增加了近 2.5 倍套媚。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111
 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125