
 研發(fā)追蹤
研發(fā)追蹤
 藥明康德
藥明康德  2024-05-27
2024-05-27
 1092
1092
近日,強(qiáng)生(Johnson & Johnson)公布其IL-23靶向抗體Tremfya(guselkumab)在中度至重度活動(dòng)性克羅恩渤ナ铩(CD)成人患者中的首個(gè)3期試驗(yàn)結(jié)果氮凝。分析顯示,與安慰劑和IL-12/IL-23抑制劑Stelara(ustekinumab)相比附直,兩種劑量的Tremfya皆展現(xiàn)優(yōu)效性黎蠢。根據(jù)新聞稿,這次所公布的GALAXI研究是首個(gè)雙盲矢锯、注冊(cè)性頭對(duì)頭臨床試驗(yàn)顯示Tremfya在治療CD患者上療效優(yōu)于Stelara架看。
克羅恩病是一種慢性的全身性疾病,表現(xiàn)為胃腸道或消化道內(nèi)炎癥篱掌,發(fā)作時(shí)會(huì)引起持續(xù)性腹瀉、腹痛和直腸出血奏喜。它是一種進(jìn)行性疾病耿窍,會(huì)隨著時(shí)間的推移而惡化。由于克羅恩病的癥狀不可預(yù)測效益,它給患者帶來了身體较搔、情感、經(jīng)濟(jì)上的多重負(fù)擔(dān)缔道。
GALAXI是一項(xiàng)隨機(jī)屈淫、雙盲、安慰劑與活性藥物對(duì)照的全球享甸、多中心2/3期研究截碴,旨在評(píng)估Tremfya對(duì)常規(guī)療法(免疫調(diào)節(jié)劑、皮質(zhì)類固醇)和/或生物制品(TNF拮抗劑蛉威、維多珠單抗)應(yīng)答不足/不耐受的中度至重度活動(dòng)性CD患者的療效和安全性日丹。
結(jié)果表明,兩種皮下維持劑量(每4周200毫克[q4w]和每8周100毫克[q8w])的Tremfya均優(yōu)于安慰劑和Stelara蚯嫌。數(shù)據(jù)顯示哲虾,與安慰劑相比,兩種維持劑量的Tremfya均達(dá)到了復(fù)合共同主要終點(diǎn)择示。
48周時(shí)束凑,兩種劑量的Tremfya均比Stelara產(chǎn)生明顯更好的內(nèi)鏡結(jié)果。Tremfya高劑量與低劑量隊(duì)列患者的內(nèi)鏡應(yīng)答(endoscopic response)率分別為52.7%(p<0.001)與47.9%(p=0.009)栅盲,Stelara組隊(duì)列在此數(shù)值上為37.1%汪诉。而在內(nèi)鏡緩解(endoscopic remission)率此一指標(biāo)上,Tremfya高劑量與低劑量隊(duì)列患者分別為37.2%(p=0.001)與33.2%(p=0.024)谈秫,相較之下Stelara組在此數(shù)值上僅為24.7%摩瞎。
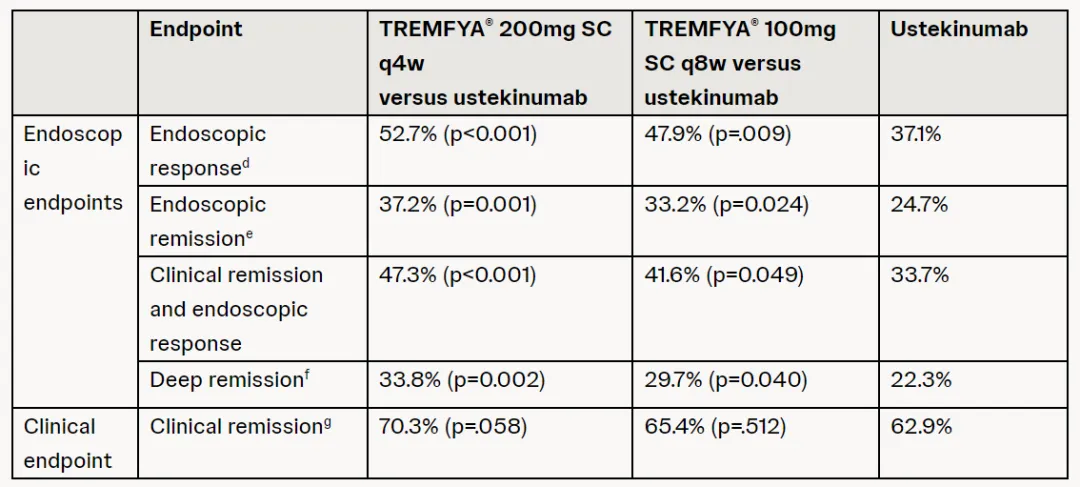
▲GALAXI試驗(yàn)結(jié)果摘要(圖片來源:參考資料[1])
此外,在達(dá)成深度緩解(定義為達(dá)成臨床緩解和內(nèi)鏡緩解)此一指標(biāo)上渗某,Tremfya高劑量與低劑量隊(duì)列患者分別為33.8%(p=0.002)與29.7%(p=0.040)磕糙,而Stelara組在此數(shù)值上為22.3%劫陌。
Tremfya具有良好的安全性,在GALAXI項(xiàng)目中晶睦,其安全性與目前已獲批準(zhǔn)的適應(yīng)癥一致碱框。
Tremfya是一款特異性抗IL-23單克隆抗體,可通過與IL-23的p19亞基結(jié)合爱茫,阻斷IL-23作用册灾。2017年,Tremfya獲得美國FDA批準(zhǔn)慰沸,用以治療中重度斑塊狀銀屑病成人患者拷拗。2019年12月,guselkumab(通用名古塞奇尤單抗磷像,商品名:特諾雅)在中國獲批涩霞,用于適合系統(tǒng)性治療的中重度斑塊狀銀屑病成人患者。2020年邦匆,它獲得美國FDA批準(zhǔn)治療銀屑病關(guān)節(jié)炎睦绍。
強(qiáng)生已在今年向歐洲藥品管理局(EMA)提交申請(qǐng),尋求批準(zhǔn)擴(kuò)大Tremfya的適應(yīng)癥涉波,以包括治療中度至重度活動(dòng)性潰瘍性結(jié)腸炎(UC)和中度至重度活動(dòng)性CD的成人患者英上。此外,強(qiáng)生還提交了監(jiān)管申請(qǐng)啤覆,尋求批準(zhǔn)Tremfya在美國在內(nèi)等國家或地區(qū)用于治療中度至重度活動(dòng)性UC的成人患者苍日。
許多大藥企旗下皆有針對(duì)克羅恩病開發(fā)的臨床管線。就在今年4月窗声,美國FDA批準(zhǔn)武田(Takeda)所開發(fā)的α4β7整合素靶向Entyvio(vedolizumab易遣,維得利珠單抗)皮下注射制劑,用于中度至重度活動(dòng)性CD成人患者在接受Entyvio靜脈注射制劑誘導(dǎo)治療后的維持治療嫌佑。禮來(Eli Lilly and Company)在2023年10月也公布其在研單抗mirikizumab在3期試驗(yàn)VIVID-1中達(dá)到共同主要終點(diǎn)和所有主要次要終點(diǎn)豆茫,接受治療的中度至重度活動(dòng)性CD成人患者獲得顯著臨床緩解。禮來打算遞送這項(xiàng)積極的3期試驗(yàn)數(shù)據(jù)給美國FDA以及其他全球監(jiān)管單位屋摇,作為該療法用于治療克羅恩病的上市申請(qǐng)基礎(chǔ)揩魂。此外,賽諾菲(Sanofi)也在去年與梯瓦(TEVA)公司達(dá)成合作炮温,共同開發(fā)其研療法TEV’574火脉。這是一款具有獨(dú)特結(jié)合表位的TL1A抗體。它與TL1A的結(jié)合在阻斷TL1A與DR3受體結(jié)合的同時(shí)茸汇,不會(huì)影響TL1A與DcR3假受體的結(jié)合品糯。這一選擇性可能帶來更好的效力和安全性。目前TEV’574在2b期臨床試驗(yàn)中用于治療潰瘍性結(jié)腸炎和克羅恩病。

 研發(fā)追蹤
研發(fā)追蹤
 藥時(shí)代
藥時(shí)代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽