
 研發(fā)追蹤
研發(fā)追蹤
 細(xì)胞基因治療前沿
細(xì)胞基因治療前沿  2024-05-27
2024-05-27
 1283
1283
5月20日盅安,T細(xì)胞免疫治療領(lǐng)域領(lǐng)導(dǎo)者Atara Biotherapeutics宣布水水,已向美國FDA提交了tabelecleucel(tab-cel)的生物制品許可申請(BLA)霉猛,作為愛潑斯坦-巴爾病毒(EBV)陽性的移植后淋巴增殖性疾驳钚簟(PTLD)單藥療法州胳,用于至少接受過一次治療的成人以及兩歲以上兒科患者啡洁。
Atara 總裁兼首席執(zhí)行官 Pascal Touchon 說道:“tab-cel 的 BLA 提交胯绢,對于同種異體 T 細(xì)胞治療領(lǐng)域來說是一個重要時刻眶逐。如果tab-cel獲批况颈,將成為全球首款同種異體T細(xì)胞免疫療法,以及治療EBV陽性PTLD的首款療法洗吉」雌妫”

PTLD是一種罕見且可致命的急性血液癌癥,常見于實體器官移植(SOT)或同種異體造血細(xì)胞移植(HCT)后才嘀,發(fā)病率約1%-30%辑皿,目前,該疾病尚無獲批療法跋炕。
Tab-cel是一種同種異體的EBV特異性T細(xì)胞免疫療法赖晶,旨在靶向并消除EBV感染的細(xì)胞。此次BLA得到了超430名患者的數(shù)據(jù)支持辐烂。研究顯示:tab-cel客觀緩解率達(dá)到達(dá)到48.8%(p<0.0001)遏插。
目前,Tab-cel 已獲得美國 FDA 授予治療利妥昔單抗難治性 EBV 陽性PTLD的突破性療法以及孤兒藥認(rèn)定纠修。
Tab-cel 已進(jìn)入包括冰島胳嘲、挪威和列支敦士登,以及27個歐盟成員國市場扣草。2022年12月了牛,歐盟委員會批準(zhǔn)tab-cel上市(商品名“Ebvallo”)。2023年5月辰妙、2024年5月鹰祸,英國和瑞士分別批準(zhǔn)tab-cel上市。
同種異體密浑,又被稱為“現(xiàn)貨”(off-the-shelf)和通用型蛙婴,是從健康的捐贈者那里收集T細(xì)胞或干細(xì)胞來源的T細(xì)胞,經(jīng)過工程化設(shè)計表達(dá)CAR秤暮,以識別和摧毀癌細(xì)胞钢谍,并限制病人自身免疫反應(yīng)。相比自體T細(xì)胞療法歧织,現(xiàn)貨型Ebvallo有望解決成本過高的問題亏的,并規(guī)避制備能耗咖杉、時長、高度“定制化”與無法形成規(guī)那荆化效應(yīng)帶來的可及性限制因素灰蒋。
放眼國內(nèi),布局同種異體細(xì)胞療法的公司有傳奇生物捅悦、亙喜生物萍捌、科濟(jì)生物、茂行生物目露、晨泰醫(yī)藥逗耕、濟(jì)因生物等。
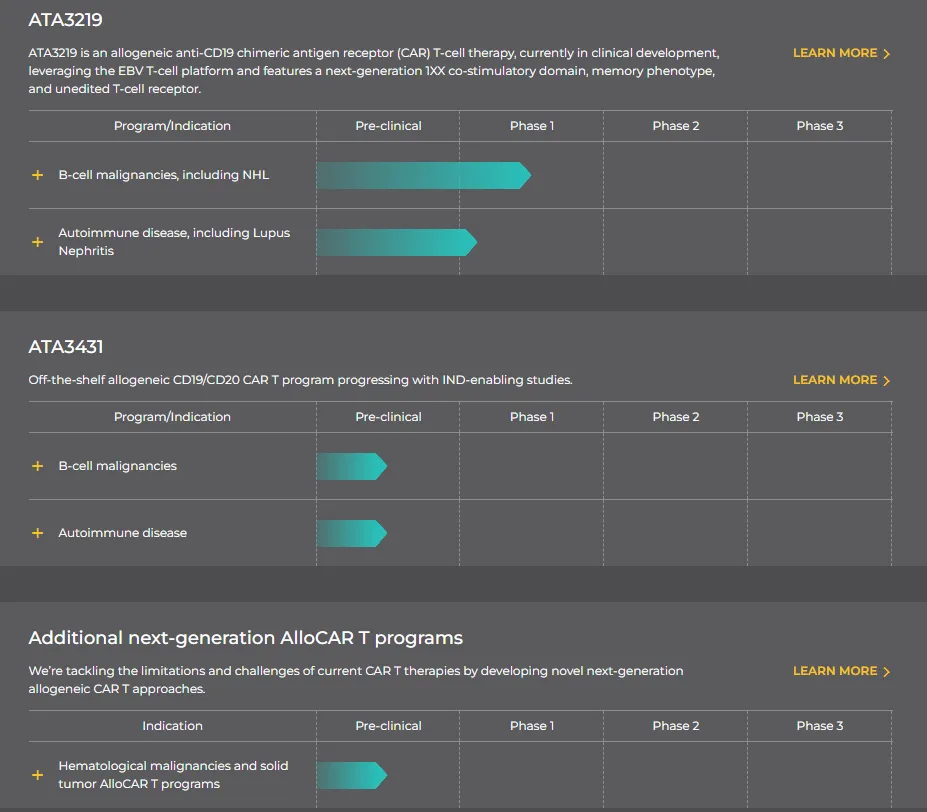
關(guān)于Atara BiotherapeuticsAtara Biotherapeutics于2012年8月成立惯波,是一家領(lǐng)先的現(xiàn)成同種異體T細(xì)胞免疫治療公司摘肤,為癌癥、自身免疫性疾病和病毒性疾病患者開發(fā)新型治療方法漏峰。Atara最先進(jìn)的T細(xì)胞免疫療法是tabelecleucel糠悼。而Tab-cel還開發(fā)了用于B細(xì)胞淋巴瘤的同種異體CAR-T療法ATA3219、ATA3431以及用于多發(fā)性硬化癥的現(xiàn)貨型T細(xì)胞療法ATA188浅乔。其中倔喂,ATA3219于今年3月份獲得FDA批準(zhǔn)用于治療狼瘡性腎炎的IND申請,成為全球首個自免適應(yīng)癥獲批臨床的通用型CAR-T療法靖苇。這是ATA3219繼非霍奇金淋巴瘤(NHL)后獲得的第二個IND批件席噩。
研發(fā)管線

參考資料:
https://investors.atarabio.com/news-events/press-releases/detail/348/atara-biotherapeutics-submits-tabelecleucel-tab-cel

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊