
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 識林
識林  2024-06-11
2024-06-11
 438
438
美國 FDA 外周和中樞神經(jīng)系統(tǒng)藥物專家會于兩個小時前剛剛結(jié)束弛秋,以 11 票對 0 票一致推薦批準禮來公司用于治療早期阿爾茨海默病的藥物 donanemab底盅,裁定該藥減緩患者認知能力下降的療效超過了其安全性風險悯许。
對于 Donanemab 的監(jiān)管決定已經(jīng)推遲了兩次躯砰,禮來最初表示預(yù)計 FDA 于 2023 年底作出決定,但后來推遲到今年第一季度创倔,今年三月份 FDA 再次決定推遲作出審批決定的日期嗡害,并要求召開專家會討論。在經(jīng)過一天的討論后却值,這一投票結(jié)果對于禮來是最好的情況卑竹,這使得 FDA 很可能會批準 donanemab 用于因阿爾茨海默而被診斷為輕度認知障礙的廣大人群。FDA 預(yù)計將于今年晚些時候做出決定私闭。禮來公司股價上漲了 2%收黔。
在專家會的報告上,F(xiàn)DA 介紹了有關(guān) donanemab 安全性的幾個懸而未決的問題匙桦,但似乎最有可能采取的方式是在標簽上強調(diào)藥物的風險颊嘱,而不是阻礙批準。專家組成員阁陌,斯坦福大學(xué)神經(jīng)學(xué)家 Kathleen Poston 表示腊拍,“只要風險受到監(jiān)控,獲益就大于風險奖朴〈羰纾”
Donanemab 的作用原理是清除大腦中的有毒斑塊 — 淀粉樣蛋白。如果獲得批準曼刀,這將是繼衛(wèi)材和渤健的同類抗體 Leqembi 之后第二個上市的此類藥物罗卿。
FDA 請求專家組成員討論將該藥的使用限制在 tau 蛋白達到一定水平的患者中的可能性。禮來在試驗中測量了這種蛋白魂务。最終曼验,許多專家決定,由于必須對患者進行 tau 蛋白掃描存在實際挑戰(zhàn)粘姜,因此不應(yīng)要求評估 tau 蛋白鬓照。
雖然專家們投票認為這些藥物的整體獲益大于風險熔酷,但專家們也確實對一小部分擁有兩個 APOE4 基因變異副本的患者的風險表示擔憂,因為這些患者更有可能在淀粉樣蛋白清除治療中出現(xiàn)腦腫脹的副作用豺裆。專家還對非裔美國人和拉美人群在禮來試驗中的代表性較低表示擔憂拒秘。
專家組對于禮來在試驗中采取的獨特方法(即,停止對淀粉樣斑塊已清除患者的治療)提出了質(zhì)疑臭猜。專家們表示躺酒,雖然這是一種創(chuàng)新方法,但現(xiàn)實世界中如何實施仍存在不確定性蔑歌,例如羹应,患者停止用藥后治療效果能持續(xù)多久,患者應(yīng)多久接受一次監(jiān)測以確定是否需要重新開始治療丐膝。
將禮來的 donanemab 與衛(wèi)材/渤健的 Leqembi 相比孽衩,donanemab 在試驗中顯示出比 Leqembi 在其臨床試驗中更高的療效箫俯,但禮來的藥也與更高的腦腫脹和腦微小出血相關(guān)焕徽。Donanemab 每月通過靜脈輸注給藥一次;Leqembi 需要每兩周輸注一次怕事。不過衛(wèi)材和渤健已開發(fā)出一種新的 Leqembi 皮下注射劑型竹恃。
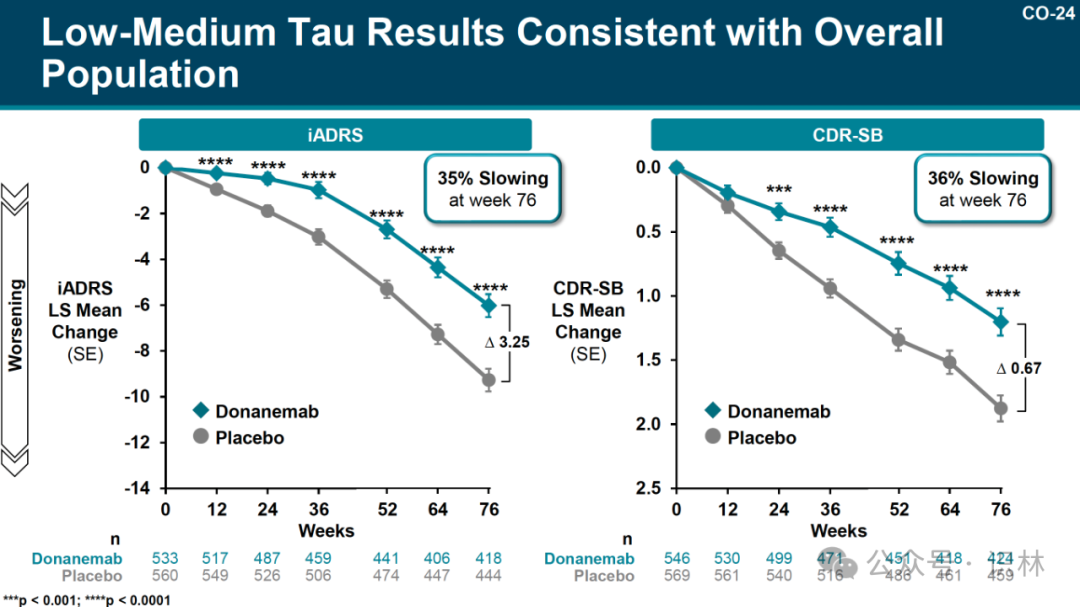
在 donanemab 的關(guān)鍵 3 期試驗中,tau 水平低至中度的患者似乎獲得了最大獲益旅测,根據(jù) iADRS(綜合阿爾茨海默病評定量表)的衡量病情減緩了 35%肘勾, 根據(jù) CDR-SB(臨床癡呆評定量表-總計分)的傳統(tǒng)評價表病情減緩了 36%。(見下圖)
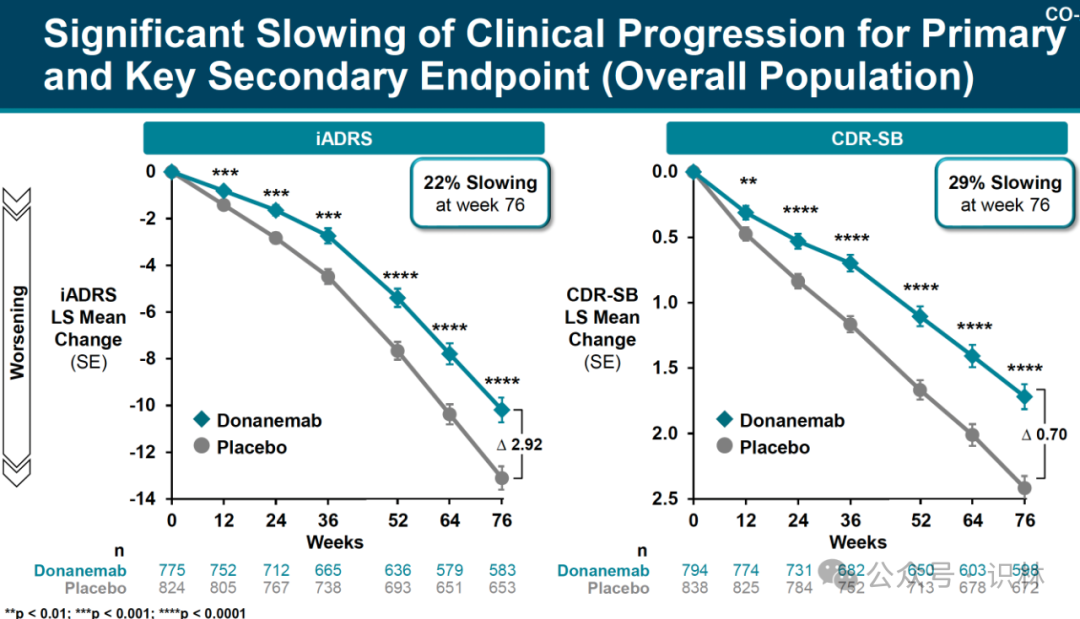
縱觀所有參加試驗的患者兆布,其中包括 tau 水平低至中度和高度的患者箫废,donanemab 在 iADRS 上使病情減緩了 22%,在 CDR-SB 上使病情減緩了 29%佛或。(見下圖)
Tau 水平為零或較低的患者被排除在試驗之外譬功,但這些患者被納入了一項補充研究,根據(jù)生物標志物測量結(jié)果弧跑,他們在研究中經(jīng)歷了積極的治療應(yīng)答奋隶。一些專家表示擔心,tau 水平為零或較低的患者的數(shù)據(jù)較少悦荒,不過專家們也表示唯欣,附錄研究中的生物標志物數(shù)據(jù)讓他們感到放心,而且在現(xiàn)實生活中對患者進行 tau 掃描非常困難搬味,尤其是會增加患者負擔無法做到公平境氢。
專家組成員、梅奧診所神經(jīng)科學(xué)系主任 Nilüfer Ertekin-Taner 表示碰纬,“納入正電子發(fā)射斷層掃描(PET)tau 蛋白的要求將進一步限制能夠獲得這類藥物的患者數(shù)量产还。這是一個微妙的情況,一方面,我們確實需要有關(guān)沒有和非常低 tau 蛋白的人群的額外數(shù)據(jù)脐区,另一方面愈诚,我們不應(yīng)該要求進行 tau PET 檢查才能獲得這些藥物∨S纾”

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍觀
深藍觀  2024-11-28
2024-11-28
 45
45

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 48
48

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 48
48