
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 制藥視界
制藥視界  2024-06-14
2024-06-14
 525
525
6月10日丈轻,F(xiàn)DA外周和中樞神經(jīng)系統(tǒng)藥物咨詢委員會(PCNS)就禮來開發(fā)的阿爾茨海默病藥物Donanemab(多納單抗)開會討論今伏,11:0全票支持Donanemab的有效性,對于ARIA副作用等問題棕凉,同樣11:0投票認為獲益大于風險。
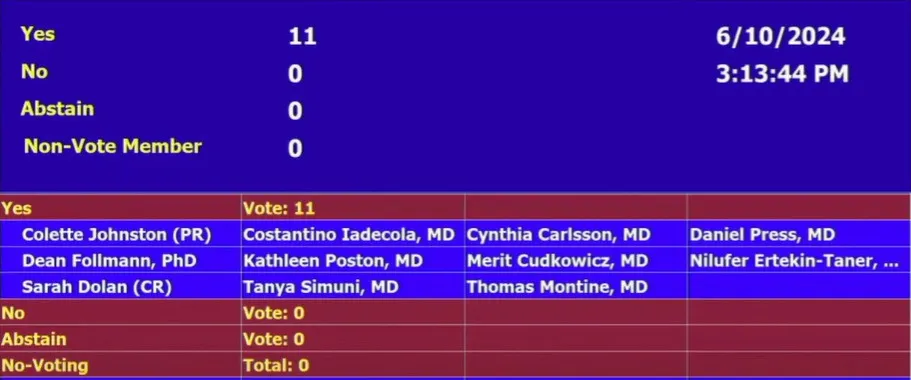
雖然FDA不必遵循咨詢委員會的建議浪熙,但今天會議一致性的投票結(jié)果增加了donanemab獲批準的可能性桃镐,為該藥物的上市批準鋪平了道路,更為早期阿爾茨海默病患者帶來了新的希望锨蹄。FDA通常在咨詢委員會召開后1-2個月做出監(jiān)管決定杈鸵。
Donanemab是一款針對AD病理蛋白(Aβ蛋白)的IgG1單克隆抗體,能夠與AD患者大腦中沉積中的Aβ結(jié)合,從而促進患者大腦中致病蛋白的清除吠冒,改善患者癥狀紧视,減緩疾病進展。
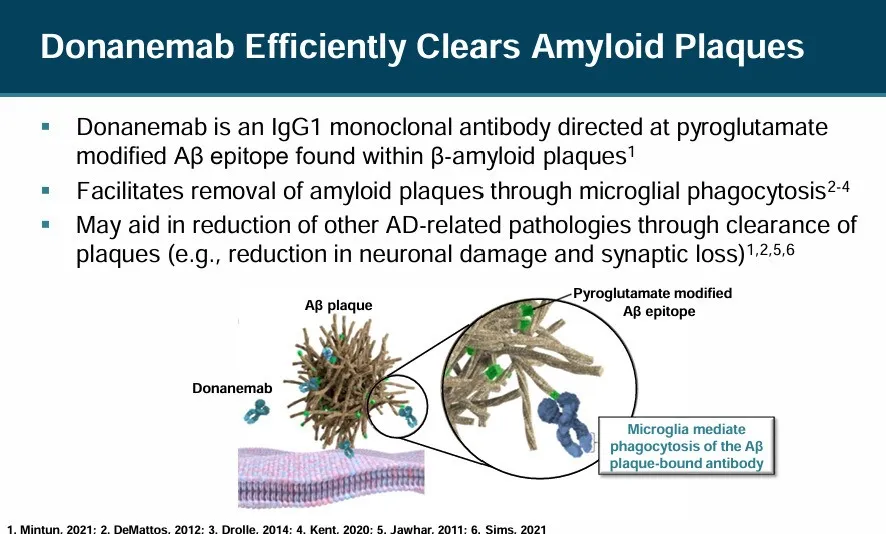
Donanemab治療早期癥狀性阿爾茨海默病的TRAILBLAZER-ALZ 2是一項隨機焙恬、雙盲硝荚、安慰劑對照的III期臨床試驗,評估了該藥物在60-85歲早期癥狀性阿爾茨海默病患者中的安全性和有效性琢窗,共入組了1736患有早期癥狀性阿爾茨海默病以及類淀粉蛋白和tau病理的參與者焙蹭,按照其tau水平,分為低-中等tau組或高tau組(疾病進展的后期病理階段)嫂伞。
在 donanemab 的關鍵 3 期試驗中孔厉,tau 水平低至中度的患者似乎獲得了最大獲益。根據(jù) iADRS(綜合阿爾茨海默病評定量表)的衡量病情減緩了 35%帖努, 根據(jù) CDR-SB(臨床癡呆評定量表-總計分)的傳統(tǒng)評價表病情減緩了 36%烟馅。(見下圖),研究結(jié)果顯示然磷,該藥物顯著減緩了認知能力的下降郑趁。
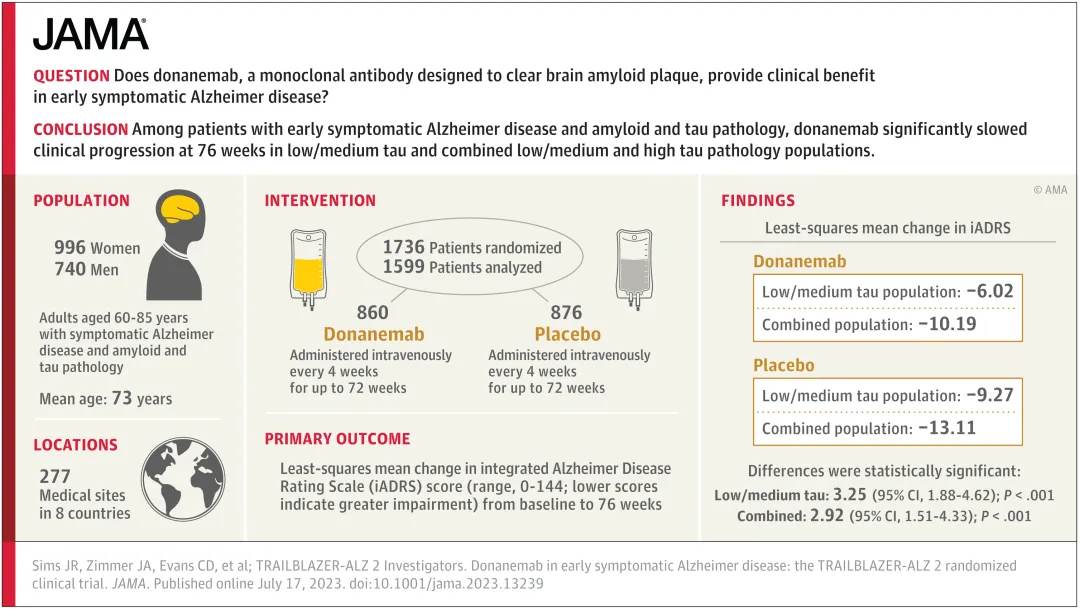
TRAILBLAZER-ALZ 2試驗設計與結(jié)果摘要
此外,參與者在日匙怂眩活動能力方面的下降減少了40%寡润,疾病進展風險降低了39%。不過舅柜,試驗也暴露了Donanemab的一些副作用梭纹,包括24%的參與者出現(xiàn)腦腫脹,31%出現(xiàn)微出血致份,且在約1.6%的病例中晶襟,這些副作用是致命的,導致了3名患者的死亡挣仅。
據(jù)FDA官網(wǎng)發(fā)布的會議文件笼肴,對Donanemab的評估非常詳細,重點關注了該藥物的安全性和有效性胀司。委員會認為Donanemab的好處超過了其風險峦爪,并認為禮來公司提供的數(shù)據(jù)證明了藥物的有效性。在討論中坚达,專家們指出辅蜡,盡管Donanemab存在風險,但這些風險是可以管理的鹦卫,并且不應該阻礙藥物的批準迅撑。
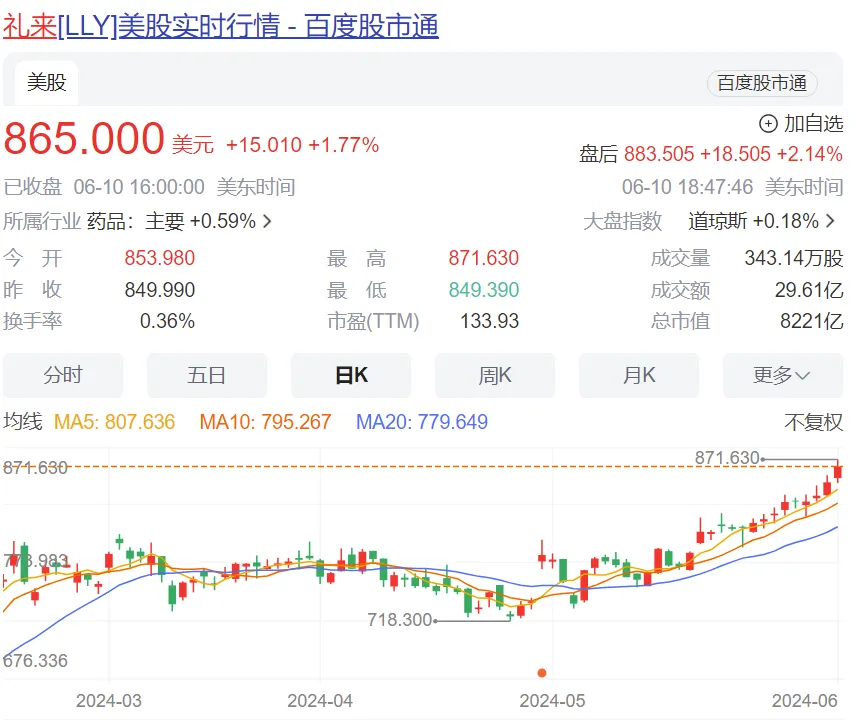
禮來公司股價上漲了 2%门贫,市值超過8400億美元!
FDA的審查
FDA對Donanemab的決定已經(jīng)被推遲兩次驼功,但咨詢委員會的投票是一個關鍵轉(zhuǎn)折點玷秋,可能為禮來公司三十年來開發(fā)減緩癡呆癥藥物的努力帶來積極結(jié)果。
禮來公司仍在對該藥物繼續(xù)進行臨床研究旺订,如TRAILBLAZER-ALZ 3弄企,該研究旨在預防阿爾茨海默病的發(fā)生。
咨詢委員會的投票結(jié)果為Donanemab的批準鋪平了道路区拳,盡管存在一些安全性和適用性的問題拘领,但專家們普遍認為這些可以通過適當?shù)墓芾砗椭笇斫鉀Q。如果獲得批準樱调,Donanemab將與Leqembi競爭约素,后者2023年獲得FDA有條件批準上市,并且于2024年獲得中國藥監(jiān)局批準笆凌。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍觀
深藍觀  2024-11-28
2024-11-28
 41
41

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 44
44

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 43
43