
 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-06-17
2024-06-17
 1044
1044
6月12日,阿斯利康的Farxiga(達(dá)格列凈)獲美國FDA批準(zhǔn)缩搅,用于改善10歲及以上2型糖尿惨杭搿(T2D)患兒的血糖控制城侧。Farxiga此前在美國被批準(zhǔn)用于成人患者炒耀,作為飲食和運(yùn)動的輔助藥物映凳,以改善血糖控制沧牧。
FDA的批準(zhǔn)是基于III期T2NOW試驗(yàn)的陽性結(jié)果拟艳,T2NOW研究是一項(xiàng)為期26周的隨機(jī)煮泪、雙盲标康、多中心III期臨床,旨在評估在接受二甲雙胍酌非、胰島素或兩者并用治療的兒童和青少年2型糖尿病患者中胃肖,達(dá)格列凈作為附加治療的有效性和安全性。研究共納入245名患者叭静,隨機(jī)分配接受5mg達(dá)格列凈(n=81)扇蚯、2.5mg沙格列汀(saxagliptin颤榛,n=88)和安慰劑(n=76)治療柿糖。第12周時,達(dá)格列凈和沙格列汀組中HbA1c≥7%的患者進(jìn)一步按照1:1的比例隨機(jī)分配惰瓜,以繼續(xù)給藥或增加至更高劑量(10mg達(dá)格列凈或5mg沙格列汀)否副。主要終點(diǎn)是第26周HbA1c的變化汉矿,次要終點(diǎn)包括空腹血糖(FPG)的變化和26周后HbA1c<7.0% (53mmol/mol)的患者比例。安全性評估超過52周备禀。結(jié)果顯示洲拇,主要終點(diǎn)方面,第26周時達(dá)格列凈組患者的HbA1c調(diào)整后平均降低0.62%曲尸,安慰劑組增加0.41%赋续,二者差值為1.03%;沙格列汀組患者的HbA1c調(diào)整后平均增加0.06%另患,安慰劑組增加0.5%纽乱,二者差值為0.44%。其它次要終點(diǎn)也均得到統(tǒng)計學(xué)意義的改善昆箕。
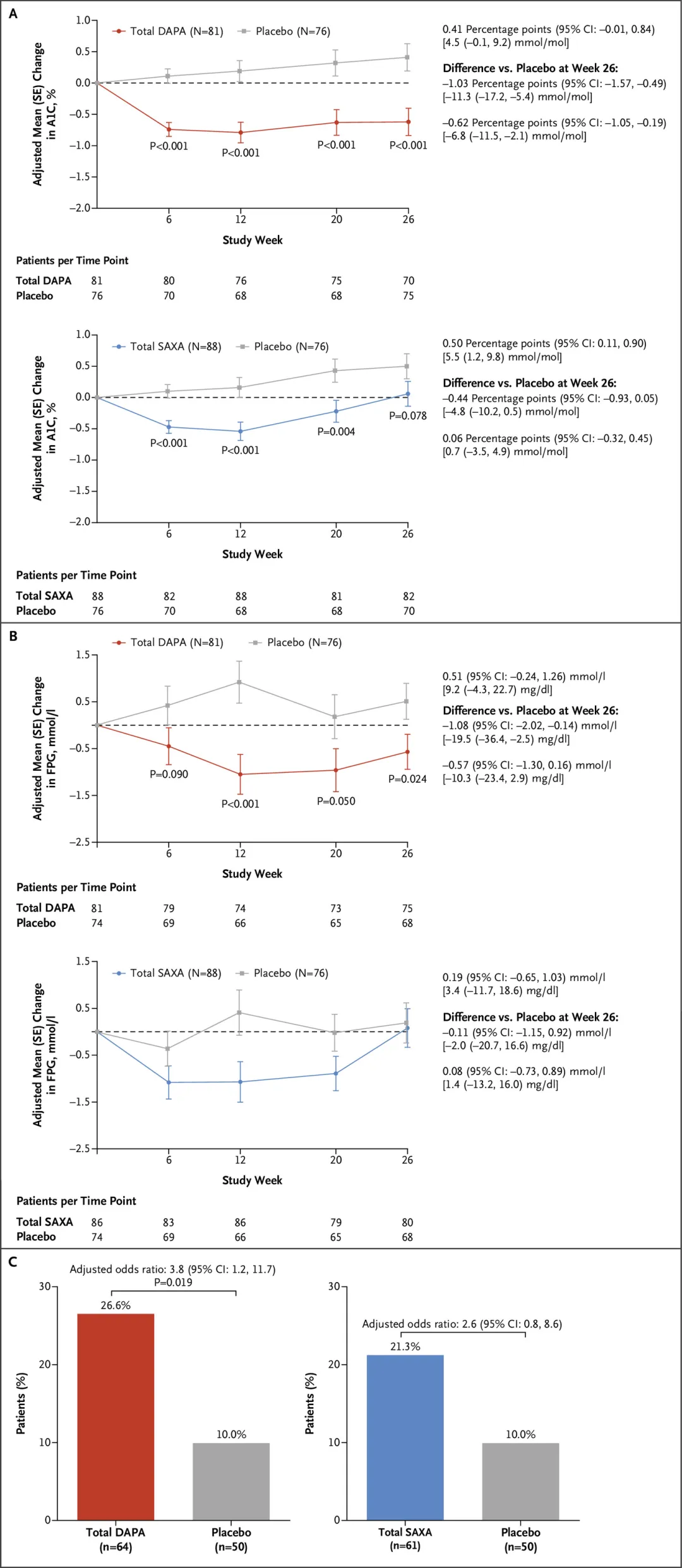
主要和次要終點(diǎn)(來源:《新英格蘭醫(yī)學(xué)雜志》)
安全性方面鸦列,達(dá)格列凈在兒童和青少年2型糖尿病患者的安全性與在成人患者中一致。T2D是一種影響所有年齡段人群的慢性疾病鹏倘。在全球范圍內(nèi)策退,兒童和青少年中T2D的發(fā)病率和患病率正在上升。根據(jù)美國疾病控制與預(yù)防中心和最近的研究气穴,在美國跑腮,有近3萬名20歲以下的T2D患者,每年有5300例新診斷病例肉敏。與成人相比慰乾,年輕患者往往出現(xiàn)更早的并發(fā)癥和更快的疾病進(jìn)展。

 研發(fā)追蹤
研發(fā)追蹤
 藥時代
藥時代  2024-09-02
2024-09-02
 107
107

 研發(fā)追蹤
研發(fā)追蹤
 醫(yī)藥魔方
醫(yī)藥魔方  2024-09-02
2024-09-02
 111
111

 研發(fā)追蹤
研發(fā)追蹤
 藥融圈
藥融圈  2024-09-02
2024-09-02
 125
125
 熱門資訊
熱門資訊