
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 Insight數(shù)據(jù)庫(kù)
Insight數(shù)據(jù)庫(kù)  2024-06-18
2024-06-18
 422
422
據(jù) Insight 數(shù)據(jù)庫(kù)統(tǒng)計(jì)捍瘩,本周(6 月 9 日—6 月 15 日)全球共有 45 款創(chuàng)新藥(含改良新)研發(fā)進(jìn)度推進(jìn)到了新階段函唾,其中 2 款獲批上市殷彰,1 款申報(bào)上市射屿,5 款獲批臨床,9 款申報(bào)臨床哺肘。
下文殴胧,Insight 將分別摘取國(guó)內(nèi)外部分重點(diǎn)項(xiàng)目做介紹。
國(guó)內(nèi)創(chuàng)新藥進(jìn)展
國(guó)內(nèi)部分佩迟,本周共有 33 款創(chuàng)新藥(含改良新)研發(fā)進(jìn)度推進(jìn)到了新階段团滥。
雖然本周新藥總體動(dòng)態(tài)較少,但獲批動(dòng)態(tài)活躍报强。并且本周值得一提的重點(diǎn)事件無疑是 2024 年度的醫(yī)保目錄調(diào)整工作的正式開始灸姊,創(chuàng)新藥們又將開始新一年的沖刺。
本周國(guó)內(nèi)首次啟動(dòng)臨床的 4 款創(chuàng)新藥(含改良新)
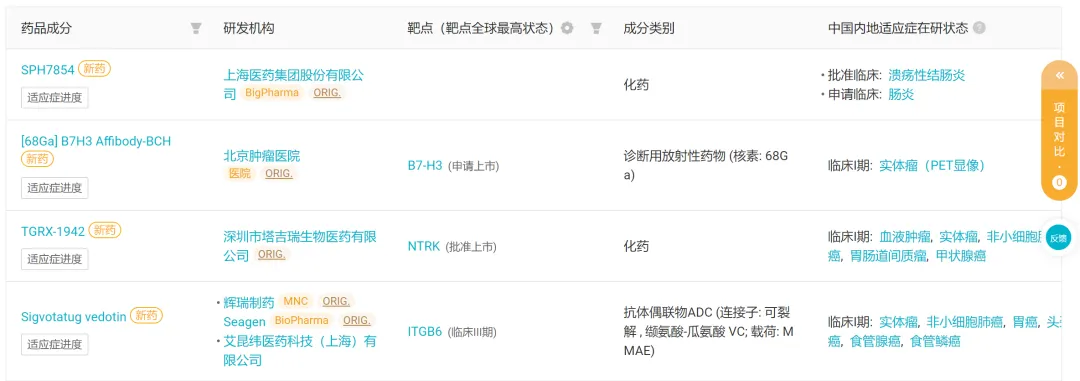
來自:Insight 數(shù)據(jù)庫(kù)網(wǎng)頁版(下文如無特殊標(biāo)注秉溉,為同一來源)
新藥首次獲批上市
1力惯、禮來制藥:「高血糖素鼻用粉霧劑」獲批上市
6 月 12 日,NMPA 官網(wǎng)顯示召嘶,禮來制藥的「高血糖素鼻用粉霧劑」國(guó)內(nèi)獲批上市夯膀,用于 4 歲及以上糖尿病患者嚴(yán)重低血糖治療。
該藥此前經(jīng) NMPA 批準(zhǔn)基于全球數(shù)據(jù)以及真實(shí)世界使用研究進(jìn)行審評(píng),免中國(guó)臨床試驗(yàn)诱建,因此得以更快在國(guó)內(nèi)申報(bào)上市蝴蜓,為國(guó)內(nèi)糖尿病患者嚴(yán)重低血糖的緊急治療提供了首個(gè)無需注射即可給藥的治療方案。



截圖來自:NMPA 官網(wǎng)
高血糖素鼻用粉霧劑最早于 2019 年 7 月獲 FDA 批準(zhǔn)上市武骆,商品名為 Baqsimi?榛舍。該藥為鼻噴給藥,在嚴(yán)重低血糖的緊急救治中硝锨,可通過患者鼻粘膜被動(dòng)吸收耽慌,無需患者進(jìn)行吸氣配合。 同時(shí)储佣,給藥者無需掌握專業(yè)技術(shù)辅任,在 30 秒內(nèi)即可完成給藥,成功率高達(dá) 90% 以上位蓉。
在國(guó)內(nèi)立漏,該藥的上市申請(qǐng)?jiān)?2022 年 8 月 1 日獲 CDE 受理,注冊(cè)申請(qǐng)主要基于針對(duì)健康人冶媚、1 型和 2 型的成人和兒童青少年糖尿病患者的 11 項(xiàng)全球研究聪戳。共計(jì)超 500 名受試者參與研究,對(duì)照藥物均為高血糖素注射液彭旬。
全球成人研究及兒科研究均證實(shí) Baqsimi? 與高血糖素注射液療效相似缰俊,安全性相似。二者治療成功率均為 100%娩梨。常見的不良反應(yīng)主要為已上市的高血糖素類藥物常見的惡心沿腰、嘔吐和頭痛等;與給藥途徑相關(guān)的不良反應(yīng)也均為輕中度和一過性狈定;真實(shí)世界使用研究則進(jìn)一步證實(shí)了 Baqsimi? 有效安全且使用便捷矫俺,94% 的給藥者認(rèn)為使用非常方便,未出現(xiàn)嚴(yán)重不良反應(yīng)掸冤。
糖尿病患者在治療過程中均可能發(fā)生血糖過低現(xiàn)象厘托。嚴(yán)重低血糖指出現(xiàn)意識(shí)和(或)軀體障礙,需要他人幫助治療的低血糖事件稿湿,危及著患者生命與生活質(zhì)量铅匹。
隨著低血糖持續(xù)時(shí)間的延長(zhǎng),血糖水平會(huì)逐漸降低饺藤,身體損害程度逐漸加重包斑,可能導(dǎo)致如意識(shí)喪失、癲癇發(fā)作涕俗、昏迷罗丰、甚至死亡等嚴(yán)重后果神帅,低血糖持續(xù) 30 分鐘即發(fā)生不可逆的腦損傷。
在高血糖素類產(chǎn)品中腊囤,此前中國(guó)僅有高血糖素注射液几菲,但由于其需要冷藏保存,且使用時(shí)操作復(fù)雜韭展,需要復(fù)溶杉唇、排氣以及專業(yè)的注射技術(shù),并不能滿足嚴(yán)重低血糖的現(xiàn)場(chǎng)急救需求酬裆,也未得到廣泛的臨床應(yīng)用辟侠。
統(tǒng)計(jì)表明,在我國(guó)發(fā)生嚴(yán)重低血糖的患者得到救助的時(shí)長(zhǎng)平均需要 2.6 小時(shí)葱有,患者得到救助時(shí)血糖水平低眨柑,血糖平均僅 1.6 mmol/L,院外現(xiàn)場(chǎng)急救成功率僅 29.7%复做。由此可見坪腔,現(xiàn)有治療手段未能充分滿足嚴(yán)重低血糖的現(xiàn)場(chǎng)急救需求。
Baqsimi? 的獲批將填補(bǔ)這一未被滿足的需求空白雷鸟,讓廣大人群都能通過簡(jiǎn)易的鼻噴給藥的方式雇寇,在嚴(yán)重低血糖事件中進(jìn)行及時(shí)氢拥、便捷的現(xiàn)場(chǎng)施救蚌铜。
2、興盟生物:狂犬病雞尾酒抗體獲批上市
6 月 12 日嫩海,興盟生物研制的 1 類創(chuàng)新藥澤美洛韋瑪佐瑞韋單抗注射液克瑞畢?取得 NMPA 頒發(fā)的藥品注冊(cè)批件冬殃,正式獲批用于成人狂犬病病毒暴露者的被動(dòng)免疫治療。
該產(chǎn)品為國(guó)內(nèi)首個(gè)符合世界衛(wèi)生組織(WHO)推薦的抗狂犬病雞尾酒抗體叁怪,為狂犬病防治提供了重要選擇审葬。

截圖來自:NMPA 官網(wǎng)
克瑞畢?具有雙靶點(diǎn)、更廣譜奕谭、起效快涣觉、早保護(hù)以及易推注、反應(yīng)輕等臨床優(yōu)勢(shì)血柳,為狂犬病暴露者提供了更為安全官册、有效的保護(hù),是國(guó)內(nèi)首個(gè)符合世界衛(wèi)生組織(WHO)推薦的抗狂犬病雞尾酒抗體难捌,此前也曾被美國(guó) FDA 授予孤兒藥資格認(rèn)定膝宁。
其獨(dú)特的「雞尾酒療法」設(shè)計(jì)使得抗體能夠精準(zhǔn)識(shí)別病毒糖蛋白的多個(gè)表位,有效中和全球狂犬病病毒流行株垮允。該抗體由澤美洛韋和瑪佐瑞韋等量混合而成籍喧,兩種單抗結(jié)合表位不連續(xù)水仑、不重疊,具有不同的抗原位點(diǎn)獨(dú)特互補(bǔ)的優(yōu)勢(shì)铃踪,有效拓寬了中和病毒譜廣度颂芒。
歷經(jīng)十年研發(fā),克瑞畢?的臨床效果與安全性在全球多項(xiàng)臨床研究中得到了充分驗(yàn)證窄切,結(jié)果證實(shí)療效與安全性均顯著優(yōu)效于抗狂犬病人免疫球蛋白(HRIG)簇茉。
研究結(jié)果顯示,克瑞畢?能夠迅速提升受試者體內(nèi)的狂犬病病毒中和抗體水平炫胡,且安全性良好哈寂,不良反應(yīng)發(fā)生率顯著低于對(duì)照組;此外狗城,同時(shí)使用狂犬病疫苗和克瑞畢?不會(huì)影響疫苗接種后狂犬疫苗中和抗體的產(chǎn)生佑茴,并且在接種狂犬病疫苗到疫苗誘導(dǎo)抗體產(chǎn)生的「空窗期」內(nèi),使用克瑞畢?后能夠更高蚊楞、更快達(dá)到人體血清保護(hù)滴度键闺。
3、諾華制藥:MET 抑制劑「卡馬替尼」獲批上市
6 月 12 日澈驼,諾華中國(guó)宣布辛燥,其治療非小細(xì)胞肺癌藥物妥瑞達(dá)?(鹽酸卡馬替尼片)獲得 NMPA 批準(zhǔn),用于未經(jīng)系統(tǒng)治療的攜帶間質(zhì)上皮轉(zhuǎn)化因子(MET)外顯子 14 跳躍突變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)成人患者缝其。
值得一提的是挎塌,為了讓中國(guó)患者盡快用上創(chuàng)新療法,妥瑞達(dá)?在中國(guó)正式獲批前内边,已于 2022 年初進(jìn)入粵港澳大灣區(qū)內(nèi)地臨床急需進(jìn)口港澳藥品醫(yī)療器械第二批目錄榴都,并在海南博鰲樂城國(guó)際醫(yī)療旅游先行區(qū)的特定醫(yī)療機(jī)構(gòu)應(yīng)用于臨床急需。

截圖來自:諾華官方公眾號(hào)
妥瑞達(dá)?(鹽酸卡馬替尼片)是一種口服生物利用度高漠其、高選擇性的特異性 MET 受體酪氨酸激酶抑制劑嘴高,可有效抑制 MET 及 MET 介導(dǎo)的下游信號(hào)蛋白的磷酸化,從而抑制腫瘤細(xì)胞的增殖和遷移和屎,并有效誘導(dǎo)細(xì)胞凋亡拴驮,展現(xiàn)出抗腫瘤活性。
支持妥瑞達(dá)?(鹽酸卡馬替尼片)在中國(guó)獲批的臨床研究數(shù)據(jù)為全球多中心臨床研究 GeoMETry mono-1 及針對(duì)中國(guó)人群的注冊(cè)臨床研究 GeoMETry-C柴信。
GeoMETry mono-1 研究顯示守犯,根據(jù)盲態(tài)獨(dú)立審查委員會(huì)評(píng)估,卡馬替尼在治療 METex14 跳躍突變的晚期非小細(xì)胞肺癌初治患者中的客觀緩解率(ORR)和疾病控制率(DCR)分別為 68.3% 和 98.3%荠补,中位總生存時(shí)間(OS)為 25.5 個(gè)月茄颈。
中國(guó) GeoMETry-C 臨床研究顯示,截至 2022 年 11 月 30 日數(shù)據(jù)截止日期宁线,卡馬替尼在一線治療 METex14 跳突晚期非小細(xì)胞肺癌患者的 ORR 為 53.3%(盲態(tài)獨(dú)立審查委員會(huì)評(píng)估)和 60%(研究者評(píng)估)去柿,與全球觀察到的數(shù)據(jù)一致弦撤,且在腦轉(zhuǎn)移患者中觀察到顱內(nèi)病灶的完全緩解率(iCR)達(dá) 50%。在安全性方面幅裳,中國(guó)患者整體不良反應(yīng)發(fā)生率與全球人群相似鼠基。
在中國(guó),肺癌的發(fā)病率和死亡率均居各類癌癥之首铆寓,而在肺癌中假怔,NSCLC 患者占比高達(dá) 80%—85%,且存在多種驅(qū)動(dòng)基因突變陵蜻。其中怕收,METex14 跳躍突變是關(guān)鍵驅(qū)動(dòng)基因之一,已被證實(shí)是非小細(xì)胞肺癌的獨(dú)立致癌因素舆瘪。
METex14 跳突會(huì)導(dǎo)致 c-Cbl 酪氨酸結(jié)合位點(diǎn)丟失片效,從而引起蛋白酶體介導(dǎo)的 MET 蛋白降解率降低,使下游信號(hào)通路持續(xù)激活英古,從而促進(jìn)腫瘤細(xì)胞的遷移淀衣、增殖和侵襲。在 NSCLC 患者中召调,METex14 跳躍突變率約為 1%-3%膨桥,常發(fā)生在年齡偏大(中位年齡為 72.5 歲)的人群中,傳統(tǒng)治療手段如化療唠叛、免疫治療效果有限只嚣,而 MET 抑制劑正是 METex14 跳躍突變的重要治療手段。
4玻墅、協(xié)和麒麟:新型口服擬鈣劑在中國(guó)獲批
6 月 12 日介牙,協(xié)和麒麟的蓋優(yōu)平?(依伏卡塞片)獲得 NMPA 正式批準(zhǔn)壮虫,用于治療慢性腎舶南帷(CKD)維持性透析患者的繼發(fā)性甲狀旁腺功能亢進(jìn)癥(SHPT)。


截圖來自:NMPA 官網(wǎng)
依伏卡塞是新一代口服擬鈣劑囚似,通過作用于甲狀旁腺細(xì)胞上的鈣敏感受體來抑制甲狀旁腺細(xì)胞的增殖及甲狀旁腺激素(PTH)的分泌姊康。
一項(xiàng)隨機(jī)、雙盲幌蹈、患者自身劑量調(diào)整碎瓢、平行分組的國(guó)際多中心研究比較了依伏卡塞和西那卡塞治療血液透析患者 SHPT 的療效與安全性。
研究結(jié)果顯示转迷,52 周時(shí)戴仁,依伏卡塞組和西那卡塞組分別有 67.3% 和 58.7% 的患者全段甲狀旁腺激素(iPTH)水平較基線下降至少 30%(組間差異為 8.6%,95% 置信區(qū)間為-1.8%乞易、19.1%)贱僚。此外鳞爱,與西那卡塞組相比,依伏卡塞組胃腸道不良反應(yīng)的發(fā)生率明顯降低(33.5% vs 50.5%吝沃,P=0.001)便师,低血鈣癥的發(fā)生率則沒有差異。
SHPT 是維持性血液透析患者最為常見且嚴(yán)重的并發(fā)癥之一俱竭,主要表現(xiàn)為 PTH 水平升高刮粥、甲狀旁腺肥大增生、鈣磷元素-礦物質(zhì)代謝紊亂等谋减。對(duì)于 CKD 患者而言牡彻,持續(xù)升高的血 PTH 會(huì)加重腎性骨營(yíng)養(yǎng)不良,誘發(fā)血管及軟組織鈣化出爹,影響患者的生活質(zhì)量讨便。當(dāng)血 PTH 濃度大于 600pg/ml,血磷水平大于 7.0 mg/dl以政,血鈣水平高于 10 mg/dl 時(shí)霸褒,患者死亡率將顯著增高。
在我國(guó)盈蛮,約 60% 的維持性透析患者有不同程度的 SHPT 表現(xiàn)废菱,而這些患者中 PTH 控制的達(dá)標(biāo)率僅為 55% 左右。目前抖誉,治療 SHPT 的療法包括營(yíng)養(yǎng)治療殊轴、營(yíng)養(yǎng)性維生素 D、活性維生素 D 及其類似物袒炉、擬鈣劑旁理、磷結(jié)合劑等。
新適應(yīng)癥獲批上市
1思早、君實(shí)生物:PD-1 單抗第 9 項(xiàng)適應(yīng)癥獲批
6 月 12 日个宾,君實(shí)生物宣布,抗 PD-1 單抗藥物特瑞普利單抗(拓益?)聯(lián)合依托泊苷和鉑類一線治療廣泛期小細(xì)胞肺癌(ES-SCLC)的新適應(yīng)癥上市申請(qǐng)已經(jīng)獲得 NMPA 批準(zhǔn)包萧。
這是特瑞普利單抗在中國(guó)獲批的第 9 項(xiàng)適應(yīng)癥颁音。


截圖來自:NMPA 官網(wǎng)
此次新適應(yīng)癥的獲批主要基于 EXTENTORCH 研究(NCT04012606)的數(shù)據(jù)結(jié)果。EXTENTORCH 研究是一項(xiàng)隨機(jī)荠划、雙盲恕下、安慰劑對(duì)照、多中心 III 期臨床研究刘纸,旨在比較特瑞普利單抗或安慰劑聯(lián)合依托泊苷及鉑類在一線治療廣泛期小細(xì)胞肺癌中的有效性和安全性桥庵,由吉林省腫瘤醫(yī)院程穎教授擔(dān)任主要研究者,在全國(guó) 51 家臨床中心聯(lián)合開展侈滚。
2023 年 5 月氯鲫,EXTENTORCH 研究的主要終點(diǎn)達(dá)到方案預(yù)設(shè)的優(yōu)效邊界比荡,特瑞普利單抗由此成為全球首個(gè)在 ES-SCLC 一線治療 III 期研究中達(dá)成總生存期(OS)和無進(jìn)展生存期(PFS)雙重主要終點(diǎn)的 PD-1 抑制劑。
2023 年 10 月舉行的歐洲腫瘤內(nèi)科學(xué)會(huì)(ESMO)大會(huì)上绕睹,EXTENTORCH 以口頭報(bào)告形式首次公布數(shù)據(jù)嘱巾。研究結(jié)果顯示,相較單純化療诫钓,特瑞普利單抗聯(lián)合化療可顯著延長(zhǎng)患者的 PFS 和 OS旬昭,且安全性良好,有望成為 ES-SCLC 免疫治療的優(yōu)選方案菌湃。
其中问拘,特瑞普利單抗組的中位 PFS 達(dá) 5.8 個(gè)月,疾病進(jìn)展或死亡風(fēng)險(xiǎn)降低 33.3%(P=0.0002)惧所,1 年 PFS 率較化療組提升近 4 倍(18.1% vs. 4.9%)骤坐;特瑞普利單抗組的中位 OS 達(dá) 14.6 個(gè)月,死亡風(fēng)險(xiǎn)降低 20.2%(P=0.0327)下愈,1 年 OS 率高達(dá) 63.1%纽绍。
肺癌是目前我國(guó)發(fā)病率和死亡率均排名首位的惡性腫瘤。SCLC 是肺癌中侵襲性最強(qiáng)的亞型势似,約占所有肺癌病例的 15%-20%拌夏,具有進(jìn)展迅速、早期轉(zhuǎn)移履因、預(yù)后差等特點(diǎn)辰诉。
SCLC 分為局限期(LS-SCLC)和廣泛期(ES-SCLC)。對(duì)于 LS-SCLC 患者越客,通過標(biāo)準(zhǔn)化療和放療敏袄,目前已可達(dá)到約 90% 的客觀緩解率和約 25% 的 5 年生存率。然而瀑兜,大部分患者在就診時(shí)坚为,已被診斷為 ES-SCLC,中位生存期不足 1 年袜娇,2 年生存率不到 10%纷炼,仍是臨床未解決的一大難題赢凫。
2输跑、安進(jìn):地舒單抗新適應(yīng)癥在華獲批
6 月 12 日,安進(jìn)的地舒單抗注射液普羅力?(英文名:Prolia?)獲得 NMPA 批準(zhǔn)样矢,用于治療骨折高風(fēng)險(xiǎn)的糖皮質(zhì)激素誘導(dǎo)的骨質(zhì)疏松癥营将,提升患者骨密度,降低骨折風(fēng)險(xiǎn)那岁。
此次獲批為長(zhǎng)期以來治療藥物不足的糖皮質(zhì)激素誘導(dǎo)的骨質(zhì)疏松癥患者提供了全新的治療選擇冗美,也為降低患者骨折致殘風(fēng)險(xiǎn)魔种、減少社會(huì)和家庭經(jīng)濟(jì)負(fù)擔(dān)增添了有效的保護(hù)屏障。
至此粉洼,普羅力?在中國(guó)已獲批 3 個(gè)適應(yīng)癥:2020 年节预,獲批治療骨折高風(fēng)險(xiǎn)的絕經(jīng)后婦女的骨質(zhì)疏松癥。2023 年属韧,獲批治療骨折高風(fēng)險(xiǎn)的男性骨質(zhì)疏松癥安拟。這兩個(gè)適應(yīng)癥都已具備醫(yī)保報(bào)銷資格,此次新獲批的 GIOP 適應(yīng)癥宵喂,也將直接實(shí)現(xiàn)醫(yī)保報(bào)銷糠赦。



截圖來自:NMPA 官網(wǎng)
此次獲批基于在全球 GIOP 患者中開展的 III 期有效性及安全性研究結(jié)果。該研究結(jié)果顯示锅棕,不論是在長(zhǎng)期服用糖皮質(zhì)激素的患者(試驗(yàn)開始前接受治療 3 個(gè)月或更長(zhǎng)時(shí)間)中拙泽,還是糖皮質(zhì)激素新用患者中(試驗(yàn)開始前接受治療小于 3 個(gè)月),普羅力?在治療 12 個(gè)月時(shí)均表現(xiàn)出比對(duì)照組(利塞膦酸鈉)更高的腰椎骨密度(BMD)增加裸燎,其治療效果不受性別顾瞻、年齡、種族及更年期狀態(tài)影響德绿,且安全性良好迈壤。
糖皮質(zhì)激素誘導(dǎo)的骨質(zhì)疏松癥(GIOP)是長(zhǎng)期使用糖皮質(zhì)激素相關(guān)的以骨強(qiáng)度下降和骨折風(fēng)險(xiǎn)升高為特征的骨骼疾病,是最常見的繼發(fā)性骨質(zhì)疏松癥磕裂。
我國(guó) GIOP 發(fā)生率高趟雄,接受激素治療的風(fēng)濕病患者骨量減少和骨質(zhì)疏松癥的發(fā)生率高達(dá) 90%,其中骨質(zhì)疏松癥確診患者超過 4 成印姑。但長(zhǎng)期以來窖夸,GIOP 的臨床診療面對(duì)諸多困境,公眾認(rèn)知度低狮贪,臨床的重視程度不夠杂员,約 1/3 患者從未接受任何規(guī)范治療;且現(xiàn)有獲批 GIOP 適應(yīng)癥的抗骨質(zhì)疏松藥物選擇較少尾杆,難以滿足 GIOP 患者的臨床需求设塑。
關(guān)鍵臨床結(jié)果
1、榮昌生物:HER2 ADC 維迪西妥單抗新適應(yīng)癥 III 期臨床成功狗丙,擬報(bào)上市
6 月 13 日譬奈,榮昌生物宣布,維迪西妥單抗 (商品名:愛地希?) 治療 HER2 陽性存在肝轉(zhuǎn)移的晚期乳腺癌患者的 Ⅲ 期臨床取得陽性結(jié)果暇昂,達(dá)到主要研究終點(diǎn)莺戒。
該項(xiàng)目已于 2021 年 6 月獲得 NMPA ?授予的突破性療法認(rèn)定,榮昌表示,計(jì)劃近期向 CDE ?遞交上市申請(qǐng)从铲。
這是一項(xiàng)在中國(guó)開展的瘪校、開放、平行對(duì)照名段、多中心的 Ⅲ 期臨床研究(RC48-C006阱扬,NCT03500380),旨在評(píng)價(jià)注射用維迪西妥單抗對(duì)比拉帕替尼聯(lián)合卡培他濱用于治療 HER2 陽性晚期乳腺癌患者的有效性及安全性伸辟。
根據(jù)本研究最終分析結(jié)果顯示价认,與拉帕替尼聯(lián)合卡培他濱相比,注射用維迪西妥單抗可顯著延長(zhǎng)患者的 PFS 自娩。注射用維迪西妥單抗安全性數(shù)據(jù)與已知風(fēng)險(xiǎn)相似用踩,未發(fā)現(xiàn)新的安全性信號(hào)。具體研究結(jié)果將在學(xué)術(shù)期刊或重大學(xué)術(shù)會(huì)議上予以公布忙迁。
根據(jù) GLOBOCAN 2022 數(shù)據(jù)脐彩,全球乳腺癌的年新發(fā)病例數(shù)達(dá) 230 萬,死亡病例數(shù)達(dá) 66 萬吠败,為女性發(fā)病率最高的癌癥发刨。在中國(guó),乳腺癌發(fā)病率和死亡率在惡性腫瘤中分別居第 6 位和第 7 位镇轿。年新發(fā)病例數(shù)達(dá) 36 萬太队,死亡病例數(shù)達(dá) 7 萬。HER2 陽性乳腺癌肝轉(zhuǎn)移發(fā)生率為 44.5%斟彻,如果不積極治療痢玖,中位生存期僅為 4-8 個(gè)月,但目前尚缺乏特異性的治療方案粟辛。
2氨案、澤璟制藥:JAK/ACVR1 雙抑制劑「吉卡昔替尼」治療重癥斑禿 III 期臨床成功,擬報(bào)上市
6 月 12 日芙掖,澤璟制藥宣布锻刺,公司自主研發(fā)的 1 類新藥鹽酸吉卡昔替尼片(曾用名:鹽酸杰克替尼片)治療重癥斑禿的 III 期臨床主試驗(yàn)(方案編號(hào):ZGJAK018)達(dá)到了主要療效終點(diǎn),達(dá)到統(tǒng)計(jì)顯著性(p<0.0001)伊镐。
澤璟表示懂版,將加快推進(jìn)鹽酸吉卡昔替尼片治療重癥斑禿患者適應(yīng)癥的上市進(jìn)程。
鹽酸吉卡昔替尼(曾用名:鹽酸杰克替尼)是澤璟自主研發(fā)的一種新型 JAK 和 ACVR1 雙抑制劑類藥物躏率,屬于 1 類新藥躯畴,公司擁有該產(chǎn)品的自主知識(shí)產(chǎn)權(quán)。
《鹽酸杰克替尼片治療重癥斑禿患者的有效性和安全性的多中心禾锤、隨機(jī)私股、雙盲摹察、安慰劑平行對(duì)照 III 期臨床試驗(yàn)》(方案編號(hào):ZGJAK018)在北京大學(xué)人民醫(yī)院恩掷、中國(guó)醫(yī)學(xué)科學(xué)院皮膚病醫(yī)院等 44 家醫(yī)院開展倡鲸,符合方案要求的 425 例重癥斑禿患者隨機(jī)入組,分配到吉卡昔替尼片 50 mg Bid 組黄娘、75 mg Bid 組或安慰劑片組峭状,經(jīng)獨(dú)立第三方非盲團(tuán)隊(duì)對(duì)該項(xiàng)試驗(yàn)中完成 24 周治療的數(shù)據(jù)進(jìn)行分析后。
結(jié)果顯示逼争,主要療效終點(diǎn)优床,即治療 24 周脫發(fā)嚴(yán)重程度工具量表(SALT)評(píng)分≤20 分的受試者百分率,吉卡昔替尼片兩組均顯著優(yōu)于安慰劑組誓焦,達(dá)到統(tǒng)計(jì)顯著性(p<0.0001)胆敞。安全性方面,吉卡昔替尼治療重癥斑禿患者的安全性與耐受性良好怕猖。
有關(guān)該項(xiàng)臨床試驗(yàn)的詳細(xì)數(shù)據(jù)酝梧,將在后續(xù)相關(guān)學(xué)術(shù)會(huì)議上公布。
目前簇寻,吉卡昔替尼治療重癥斑禿 III 期臨床研究的延伸試驗(yàn)(方案編號(hào):ZGJAK020)正在進(jìn)行中掸阶。此前,澤璟已經(jīng)公告了鹽酸吉卡昔替尼片治療重癥斑禿的 II 期臨床試驗(yàn)結(jié)果市通,該項(xiàng)臨床研究結(jié)果入選 2021 年第 30 屆歐洲皮膚病與性病學(xué)會(huì)(EADV)大會(huì)口頭報(bào)告窟著。
鹽酸吉卡昔替尼片目前還在開展多個(gè)免疫炎癥性疾病和纖維化疾病的臨床研究。2022 年 10 月苫瘾,澤璟提交的吉卡昔替尼片治療中危暇、高危骨髓纖維化適應(yīng)癥的 NDA 申請(qǐng)已經(jīng)獲得國(guó)家藥監(jiān)局受理,目前正在審評(píng)過程中湃彻。
此外频僵,公司正在開展吉卡昔替尼片用于中重度特應(yīng)性皮炎(III 期)、強(qiáng)直性脊柱炎(III 期)诚凰、特發(fā)性肺纖維化(II 期)嫌术、中重度斑塊狀銀屑病(II 期)等自身免疫性疾病的臨床試驗(yàn)牌借。鹽酸吉卡昔替尼片用于治療 12 歲及以上青少年和成人非節(jié)段型白癜風(fēng)患者的 II/III 期臨床試驗(yàn)已獲得批準(zhǔn)度气。吉卡昔替尼片用于治療骨髓纖維化的研究獲得國(guó)家「重大新藥創(chuàng)制」科技重大專項(xiàng)立項(xiàng)支持。
3膨报、君實(shí)生物:一線治療晚期肝細(xì)胞癌磷籍,PD-1 單抗新 III 期臨床達(dá)主要終點(diǎn),擬申報(bào)上市
6 月 11 日现柠,君實(shí)生物宣布院领,由公司自主研發(fā)的抗 PD-1 單抗藥物特瑞普利單抗聯(lián)合貝伐珠單抗一線治療晚期肝細(xì)胞癌(HCC)的多中心、隨機(jī)、開放比然、陽性藥對(duì)照的 III 期臨床研究 HEPATORCH 研究的主要研究終點(diǎn) PFS 和 OS 均已達(dá)到方案預(yù)設(shè)的優(yōu)效邊界丈氓。
君實(shí)生物計(jì)劃將于近期向監(jiān)管部門遞交該新適應(yīng)癥的上市申請(qǐng)。
HEPATORCH 研究(NCT04723004)是一項(xiàng)多中心强法、隨機(jī)万俗、開放、陽性藥對(duì)照的 III 期臨床研究梭唆,旨在評(píng)估與標(biāo)準(zhǔn)治療索拉非尼相比辆泄,特瑞普利單抗聯(lián)合貝伐珠單抗一線治療不可切除或轉(zhuǎn)移性 HCC 的有效性和安全性。
根據(jù)本研究分析結(jié)果踱陡,特瑞普利單抗聯(lián)合貝伐珠單抗一線治療晚期 HCC 患者铐坠,相較于索拉非尼,可顯著延長(zhǎng)患者的 PFS 和 OS荸跃,同時(shí)改善客觀緩解率和至疾病進(jìn)展時(shí)間等次要終點(diǎn)遂涛。特瑞普利單抗安全性數(shù)據(jù)與已知風(fēng)險(xiǎn)相符,未發(fā)現(xiàn)新的安全性信號(hào)冲雾。關(guān)于詳細(xì)的研究數(shù)據(jù)醉檐,君實(shí)生物將在近期國(guó)際學(xué)術(shù)大會(huì)上公布。
啟動(dòng)臨床
1奥怪、輝瑞制藥:潛在 FIC ADC 國(guó)內(nèi)啟動(dòng)臨床
6 月 12 日勿镇,據(jù) CDE 臨床試驗(yàn)登記與信息公示平臺(tái),輝瑞 ADC 新藥 SGN-B6A 在國(guó)內(nèi)啟動(dòng) I 期臨床 SGNB6A-003 研究盘瞧,針對(duì)晚期實(shí)體瘤(登記號(hào):CTR20242077)蚂兴。

來自:CDE 官網(wǎng)
SGN-B6A(Sigvotatug vedotin/SV)是輝瑞收購(gòu) Seagen 所獲得的一款潛在 FIC 靶向整合素 β6(Integrin beta-6,IB6)的 ADC 新藥膘掰。
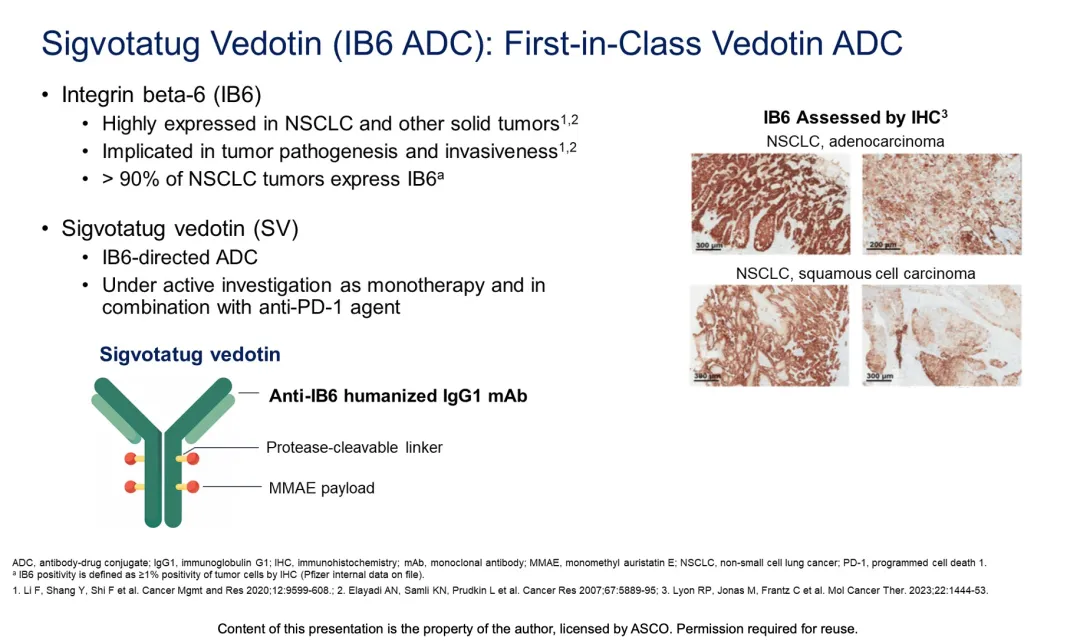
來自:ASCO2024(下文如無特殊標(biāo)注章姓,為同一來源)
2024 ASCO 大會(huì)上,輝瑞公布了 SV 針對(duì) NSCLC 的 I 期臨床 SGNB6A-001 研究(登記號(hào):NCT04389632)的更新數(shù)據(jù)识埋。該研究共有 117 名 NSCLC 患者接受劑量爬坡和劑量拓展方案凡伊,中位治療線數(shù)為3,其中 87.2% 患者接受過鉑化療窒舟,92.3% 接受過 PD-(L)1 治療系忙。結(jié)果顯示:所有 NSCLC 患者的 cORR 為 19%,mDOR 為 11.3 個(gè)月惠豺,mPFS 3.5 個(gè)月银还,mOS 11.2 個(gè)月。其中洁墙,非鱗 NSCLC 且未接受紫杉醇治療的患者 cORR 為 31%蛹疯,mDOR 為 11.6 個(gè)月戒财;且在 PFS、OS 上有更好的獲益捺弦,mPFS 以及 mOS 分別為 6.4 個(gè)月以及 16.3 個(gè)月饮寞。去年輝瑞以約 430 億美元的高價(jià)收購(gòu) Seagen,開始大力進(jìn)軍 ADC 領(lǐng)域耕粪。據(jù)今年 2 月底輝瑞腫瘤學(xué)研發(fā)日資料治盆,在已獲批上市的 ADC 新藥中绳弯,輝瑞占據(jù)了大壁江山妨宙。此外,還有多款 ADC 新藥處于臨床階段耗砖,同時(shí)也在積極開發(fā)新一代 ADC 技術(shù)伐歇。

來自:輝瑞官網(wǎng)資料
境外創(chuàng)新藥進(jìn)展
境外部分,本周共有 18 款創(chuàng)新藥(含改良新)研發(fā)進(jìn)度推進(jìn)到了新階段廉旅,其中 1 款獲批上市磁姻,1 款申報(bào)上市,4 款獲批臨床桌苔。
獲批上市
1革睬、百時(shí)美施貴寶:「瑞普替尼」新適應(yīng)癥獲批上市
6 月 14 日,百時(shí)美施貴寶公司(BMS)宣布腻喇,美國(guó) FDA 加速批準(zhǔn)了瑞普替尼竣康,用于治療局部晚期、轉(zhuǎn)移性或手術(shù)切除可能導(dǎo)致嚴(yán)重疾病瓢谢、治療后病情進(jìn)展或沒有令人滿意的替代療法的 NTRK 基因融合陽性的實(shí)體瘤成人患者和 12 歲及以上兒童患者畸写。

此次獲批是基于 1/2 期 TRIDENT-1 研究的結(jié)果,該研究評(píng)估了瑞普替尼在 NTRK 陽性成人實(shí)體瘤患者中的療效氓扛。該適應(yīng)證是根據(jù)總體緩解率和緩解持續(xù)時(shí)間獲得了加速批準(zhǔn)枯芬,完全獲批可能取決于驗(yàn)證性研究中臨床獲益的驗(yàn)證和描述。
TRIDENT-1 是一項(xiàng)全球采郎、多中心千所、單臂、開放標(biāo)簽蒜埋、多隊(duì)列 1/2 期臨床研究淫痰,評(píng)估瑞普替尼在局部晚期或轉(zhuǎn)移性 NTRK 基因融合陽性(NTRK1/2/3)實(shí)體瘤患者中的安全性、耐受性理茎、藥代動(dòng)力學(xué)和抗腫瘤活性黑界。除其他排除標(biāo)準(zhǔn)外,該研究排除了有腦轉(zhuǎn)移癥狀的患者皂林。研究的 1 期階段包括劑量遞增朗鸠,以確定 2 期推薦劑量蚯撩。
NTRK 陽性局部晚期/轉(zhuǎn)移性實(shí)體瘤隊(duì)列的 2 期研究主要終點(diǎn)是由獨(dú)立盲法中心(BICR)評(píng)估的客觀緩解率(ORR)。次要研究終點(diǎn)包括由獨(dú)立盲法中心根據(jù) RECIST v1.1 標(biāo)準(zhǔn)評(píng)估的緩解持續(xù)時(shí)間(DOR)抵刺、在基線時(shí)有可評(píng)估中樞神經(jīng)系統(tǒng)轉(zhuǎn)移患者的顱內(nèi)反應(yīng)饲悟。
TRIDENT-1 研究納入了 40 名 TKI 初治患者和 48 名接受過 TKI 治療的患者,這些受試者患有 NTRK 陽性的局部晚期或轉(zhuǎn)移性實(shí)體瘤衫喜,涵蓋了 15 種不同類型的癌癥根朱。
在 TKI 初治患者中,中位隨訪時(shí)間為 17.8 個(gè)月可丝,客觀緩解率(cORR)為 58%(95% CI:41-73)敏盒,其中 43% 的患者達(dá)到部分緩解(PR),15% 的患者達(dá)到完全緩解(CR)氓愿。在這些達(dá)到緩解的患者中翁凳,83% 的患者在接受瑞普替尼治療一年后仍持續(xù)緩解,中位持續(xù)緩解時(shí)間(mDOR)尚未達(dá)到咪轩。
在接受過 TKI 治療的患者中县趴,中位隨訪時(shí)間為 20.1 個(gè)月,cORR 為 50% (95% CI:35-65)涉粘,其中 50% 的患者達(dá)到 PR锭汛,沒有患者達(dá)到 CR。此外袭蝗,42% 達(dá)成緩解的患者在接受瑞普替尼治療一年后仍持續(xù)緩解唤殴,mDOR 為 9.9 個(gè)月 (95% CI:7.4-13.0)。在基線時(shí)有可評(píng)估中樞神經(jīng)系統(tǒng)(CNS)轉(zhuǎn)移的患者中呻袭,2 名 TKI 初治患者和 3 名接受過 TKI 治療的患者均觀察到顱內(nèi)緩解眨八。
這是瑞普替尼在美國(guó)獲批的第二個(gè)適應(yīng)證。2023 年 11 月左电,瑞普替尼獲得 FDA 完全批準(zhǔn)廉侧,用于治療 ROS1 陽性局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌成人患者。2024 年 5 月篓足,該適應(yīng)證獲得中國(guó)國(guó)家藥監(jiān)局批準(zhǔn)段誊。
根據(jù)與 Turning Point(百時(shí)美施貴寶的全資子公司)的獨(dú)家授權(quán)許可協(xié)議,再鼎醫(yī)藥擁有在大中華區(qū)(中國(guó)內(nèi)地栈拖、香港连舍、澳門和臺(tái)灣地區(qū))開發(fā)和商業(yè)化瑞普替尼的獨(dú)家授權(quán)許可,并參與了 TRIDENT-1 研究并負(fù)責(zé)該研究在大中華區(qū)的執(zhí)行涩哟。
2审亿、阿斯利康:「達(dá)格列凈」新適應(yīng)癥獲批上市
6 月 12 日,阿斯利康宣布帝愉,美國(guó) FDA 批準(zhǔn)了達(dá)格列凈的一項(xiàng)新適應(yīng)癥最咖,用于改善 10 歲及以上 2 型糖尿采蝓巍(T2D)患兒的血糖控制。

來自:阿斯利康官網(wǎng)新聞
FDA 的批準(zhǔn)是基于 III 期 T2NOW 試驗(yàn)的積極結(jié)果碑甘,該結(jié)果此前已發(fā)表于 The New England Journal of Medicine Evidence亮铛。這是一項(xiàng)為期 26 周的隨機(jī)、雙盲销顷、多中心 III 期臨床受卒,旨在評(píng)估達(dá)格列凈作為聯(lián)合方案在接受二甲雙胍、胰島素的兒童和青少年 2 型糖尿病患者中的療效和安全性灼烫。其結(jié)果如下:
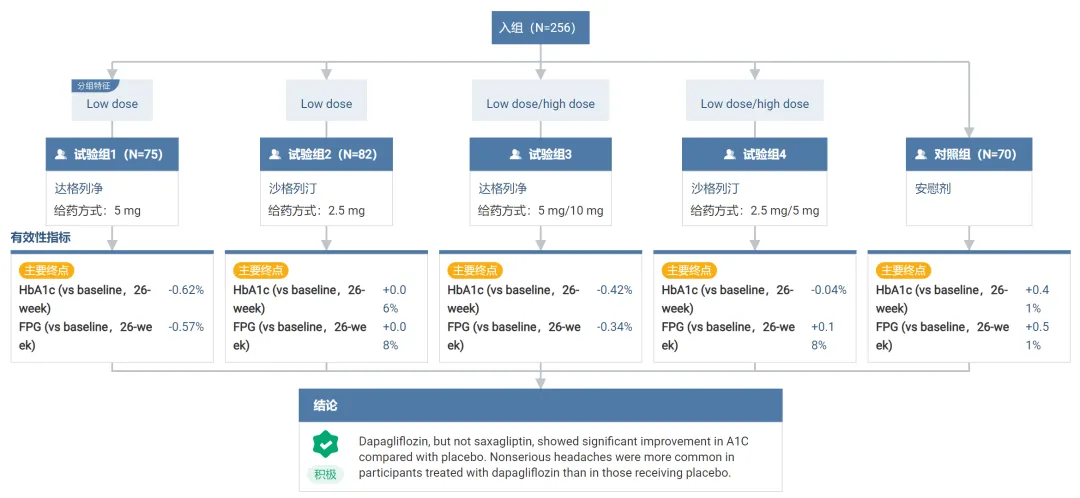
截圖來自:Insight 數(shù)據(jù)庫(kù)
申報(bào)上市
1筋蝴、阿斯利康:「奧希替尼」新適應(yīng)癥申報(bào)上市,加速肺癌適應(yīng)癥覆蓋
6 月 10 日圆乡,阿斯利康宣布奧希替尼(商品名:Tagrisso)用于治療放化療(CRT)后不可切除的 EGFR 突變型(外顯子 19 缺失或外顯子 21(L858R)突變)III 期 NSCLC 患者的新適應(yīng)癥上市申請(qǐng)獲 FDA 受理并授予優(yōu)先審評(píng)資格掰腌,預(yù)計(jì)在今年第四季度得到審評(píng)決定策橘。

來自:阿斯利康官網(wǎng)新聞
這項(xiàng)申請(qǐng)是基于 III 期臨床試驗(yàn) LAURA 研究的結(jié)果炸渡,該結(jié)果在 2024 ASCO 大會(huì)上剛剛公布,并發(fā)表于 NEJM 雜志丽已。
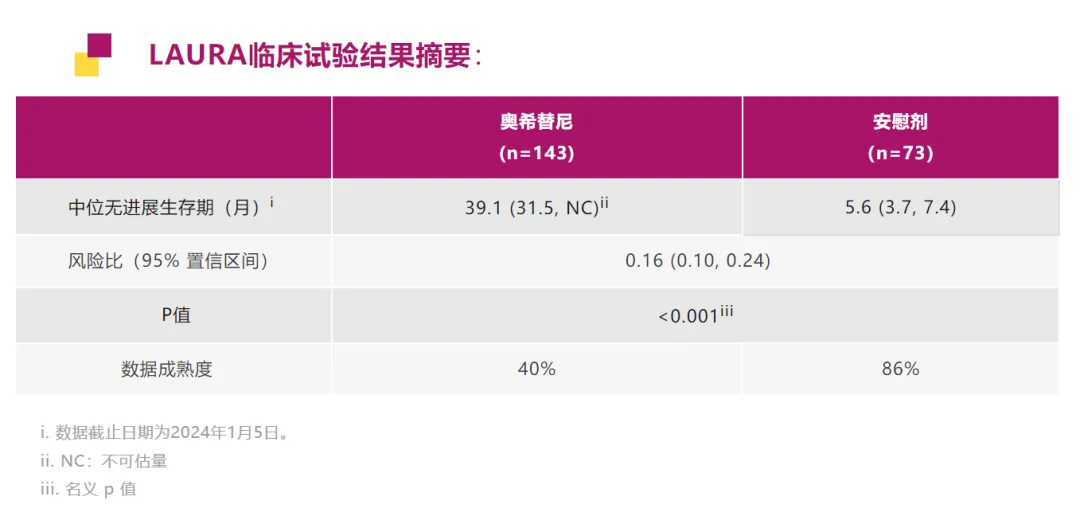
截圖來自:阿斯利康官方公眾號(hào)
經(jīng)盲態(tài)獨(dú)立審查中心 (BICR) 評(píng)估的結(jié)果顯示蚌堵,與安慰劑相比,奧希替尼將疾病進(jìn)展或死亡風(fēng)險(xiǎn)降低了 84%([HR] 0.16沛婴;95% [CI] 0.10-0.24吼畏;p<0.001)。接受奧希替尼治療組患者的中位 PFS 為 39.1 個(gè)月嘁灯,而接受安慰劑組治療患者的中位 PFS 為 5.6 個(gè)月泻蚊。更重要的是,在所有預(yù)先設(shè)定的亞組中丑婿,包括性別性雄、種族、EGFR 突變類型羹奉、年齡秒旋、吸煙史和既往對(duì) CRT 治療的應(yīng)答情況,均觀察到了具有臨床意義的 PFS 獲益诀拭。
奧希替尼的總生存期 (OS) 數(shù)據(jù)趨勢(shì)良好援丐,盡管在本次分析時(shí)數(shù)據(jù)尚未成熟。該試驗(yàn)將持續(xù)進(jìn)行传撰,評(píng)估次要終點(diǎn) OS苇给。
安全性和因不良事件 (AEs) 導(dǎo)致的停藥率與預(yù)估的一致,未發(fā)現(xiàn)新的安全性問題距搂。奧希替尼組 有 35% 的患者出現(xiàn)各種原因?qū)е碌?大于等于 3 級(jí)不良事件北淘,安慰劑組這一比例為 12%猪褐。
醫(yī)藥交易
Insight 數(shù)據(jù)庫(kù)顯示,本周共有 15 項(xiàng)醫(yī)藥交易發(fā)生攀瘟,其中包括 7 項(xiàng)授權(quán)/許可類合作和蛀、3 項(xiàng)轉(zhuǎn)讓/收購(gòu)類合作。此處將精選本周部分醫(yī)藥交易進(jìn)行介紹诉玲。
1搂棱、亞盛醫(yī)藥&武田:就第三代 BCR-ABL 抑制劑奧雷巴替尼全球許可簽署獨(dú)家選擇權(quán)協(xié)議
6 月 14 日, 亞盛醫(yī)藥宣布與武田簽署了一項(xiàng)獨(dú)家選擇權(quán)協(xié)議,就公司的具有 best-in-class 潛力的第三代 BCR-ABL 酪氨酸激酶抑制劑(TKI)耐立克?(奧雷巴替尼)達(dá)成獨(dú)家許可協(xié)議沫流。一旦選擇權(quán)被行使偏控,武田將獲得開發(fā)及商業(yè)化奧雷巴替尼的全球權(quán)利許可,惟中國(guó)大陸滑沧、中國(guó)香港特別行政區(qū)并村、中國(guó)澳門特別行政區(qū)、中國(guó)臺(tái)灣等地區(qū)除外滓技。
根據(jù)該選擇權(quán)協(xié)議的條款哩牍,亞盛醫(yī)藥將于協(xié)議簽署后收到 1 億美元的選擇權(quán)付款,并有資格獲得最高約 12 億美元的選擇權(quán)行使費(fèi)以及額外的潛在里程碑付款令漂。此外膝昆,亞盛醫(yī)藥將從武田獲得少數(shù)股權(quán)投資。
按照協(xié)議內(nèi)容叠必,在許可選擇權(quán)獲行使之前荚孵,亞盛醫(yī)藥將全權(quán)負(fù)責(zé)奧雷巴替尼的所有臨床開發(fā)事宜。奧雷巴替尼目前在中國(guó)已上市纬朝,并有兩項(xiàng)適應(yīng)癥獲批收叶,分別為治療任何 TKI 耐藥、并伴有 T315I 突變的 CML 慢性期(-CP)和加速期(-AP)的成年患者共苛;治療對(duì)一代和二代 TKI 耐藥和/或不耐受的 CML-CP 成年患者判没。
2、明濟(jì)生物&艾伯維:就開發(fā)下一代炎癥性腸病療法達(dá)成許可協(xié)議
6 月 13 日杏住,明濟(jì)生物和艾伯維共同宣布一項(xiàng)開發(fā) FG-M701 的許可協(xié)議采冕。FG-M701 是一種用于治療炎癥性腸病的下一代 TL1A 抗體,目前正處于臨床前開發(fā)階段贫拭。
FG-M701 是靶向 TL1A 的全人源單克隆抗體孩青,該靶點(diǎn)在炎癥性腸病中已獲得臨床驗(yàn)證。與第一代 TL1A 抗體相比耍叮,F(xiàn)G-M701 通過獨(dú)特的工程化改造森肉,旨在為炎癥性腸病治療提供更高的療效并減少給藥頻率,具備成為同類最佳的潛力滋评。
根據(jù)協(xié)議條款朵泌,艾伯維將獲得 FG-M701 在全球進(jìn)行開發(fā)派憨、生產(chǎn)和商業(yè)化的獨(dú)家許可權(quán)。明濟(jì)生物將獲得 1.5 億美元的首付款和近期里程碑付款岳舔,并有資格獲得后續(xù)高達(dá) 15.6 億美元的臨床開發(fā)笔碌、監(jiān)管注冊(cè)和商業(yè)化里程碑付款,以及高達(dá)凈銷售額低兩位數(shù)比例的分級(jí)特許權(quán)使用費(fèi)躲扣。
3甚脉、軒竹生物&麗珠醫(yī)藥:就復(fù)達(dá)那非(XZP-5849)達(dá)成獨(dú)家開發(fā)及商業(yè)化授權(quán)許可合作
6 月 13 日,麗珠醫(yī)藥铆农、與四環(huán)醫(yī)藥非全資附屬公司軒竹生物聯(lián)合宣布牺氨,雙方就軒竹生物自主研發(fā)的一款高選擇性 PDE-5 抑制劑復(fù)達(dá)那非(產(chǎn)品代號(hào):XZP-5849)達(dá)成獨(dú)家授權(quán)許可合作。
根據(jù)雙方已簽署的授權(quán)許可協(xié)議墩剖,麗珠醫(yī)藥將獲得復(fù)達(dá)那非(XZP-5849)產(chǎn)品原料藥和制劑在大中華地區(qū)及非規(guī)范性市場(chǎng)地區(qū)的獨(dú)家開發(fā)猴凹、生產(chǎn)及商業(yè)化權(quán)益,軒竹生物將保留復(fù)達(dá)那非在歐洲岭皂、美國(guó)郊霎、加拿大、日本蒲障、韓國(guó)歹篓、澳大利亞及巴西地區(qū)的開發(fā)、生產(chǎn)及商業(yè)化的權(quán)益揉阎。根據(jù)協(xié)議,軒竹生物將獲得預(yù)付款背捌,并有權(quán)獲得里程碑付款及最高可達(dá)兩位數(shù)的分級(jí)特許銷售分成毙籽。
復(fù)達(dá)那非是軒竹生物自主研發(fā)的一款高選擇性磷酸二酯酶 5(PDE5)抑制劑,屬于化藥 1 類新藥蝌飘,具有獨(dú)立自主的知識(shí)產(chǎn)權(quán)北拌。產(chǎn)品作用包括:1)抑制前列腺增生、顯著改善前列腺增生癥引起的下尿路癥狀跑既;2)舒張陰莖海綿體平滑肌稼崎,增加陰莖動(dòng)脈血流,改善勃起功能障礙轿白;3)通過擴(kuò)張肺動(dòng)脈清农,降低肺動(dòng)脈壓力。
更重要的是罢摧,其克服了同類藥物如西地那非栽寄、伐地那非和他達(dá)拉非等出現(xiàn)的視覺障礙、背痛等不良反應(yīng)拆聋。臨床前研究還證明纤耐,復(fù)達(dá)那非體內(nèi)清除率明顯低于阿伐那非姊呐、西地那非和伐地那非,預(yù)計(jì)人體內(nèi)具有更長(zhǎng)的半衰期助被,除了滿足勃起功能障礙(ED)患者治療以外剖张,還可以滿足治療前列腺增生引起的下尿路癥狀(BPH/LUTS)及肺動(dòng)脈高壓(PAH)患者每天給藥一次、長(zhǎng)期用藥的臨床需求揩环。目前產(chǎn)品處于 I 期臨床研究階段修械,在研適應(yīng)癥包括 ED、BPH/LUTS检盼、BPH/LUTS 合并 ED 以及 PAH肯污。
多說一點(diǎn)
6 月 13 日,醫(yī)保局發(fā)布了《2024年國(guó)家基本醫(yī)療保險(xiǎn)吨枉、工傷保險(xiǎn)和生育保險(xiǎn)藥品目錄調(diào)整工作方案》及相關(guān)文件公開征求意見蹦渣。這意味著新一年的醫(yī)保目錄調(diào)整工作已經(jīng)開始。
內(nèi)容來源:藥企官方發(fā)布新聞/資料貌亭、Insight 數(shù)據(jù)庫(kù)

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 40
40

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 44
44

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 43
43
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽