
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 罕見病信息網(wǎng)
罕見病信息網(wǎng)  2024-06-19
2024-06-19
 350
350
6月14日拗盒,國務(wù)院新聞辦公室舉行國務(wù)院政策例行吹風(fēng)會(huì)煞精,國家衛(wèi)生健康委、國家醫(yī)保局、國家疾控局卤舆、國家藥監(jiān)局負(fù)責(zé)人介紹《深化醫(yī)藥衛(wèi)生體制改革2024年重點(diǎn)工作任務(wù)》有關(guān)情況钟牛,并答記者問锁右。
國家藥監(jiān)局副局長黃果介紹冷泵,近年來,國家藥監(jiān)局通過深化藥品審評(píng)審批制度改革捅硅,鼓勵(lì)完簿、引導(dǎo)和服務(wù)藥品創(chuàng)新研發(fā),一大批創(chuàng)新藥桅蕊、創(chuàng)新醫(yī)療器械獲批上市聚灸。

國家藥監(jiān)局副局長黃果 ?國新網(wǎng) 圖
黃果表示娇皇,在服務(wù)臨床用藥需求方面,將臨床急需的短缺藥湿斩、兒童用藥籍投、罕見病用藥削蕊、重大傳染病用藥忧埠、疾病防控急需疫苗和創(chuàng)新疫苗等納入加快審評(píng)審批范圍,鼓勵(lì)以臨床為導(dǎo)向元丈、以患者為中心的藥物研發(fā)坤乌。例如大家比較關(guān)注的罕見病治療藥物,2022年批準(zhǔn)上市3個(gè)显驼,2023年批準(zhǔn)45個(gè)哼御,2024年前五個(gè)月已經(jīng)批準(zhǔn)24個(gè),可以說罕見病治療藥物上市數(shù)量大幅增加焊唬,讓很多罕見病患者不再無藥可治恋昼,能夠切實(shí)受益。
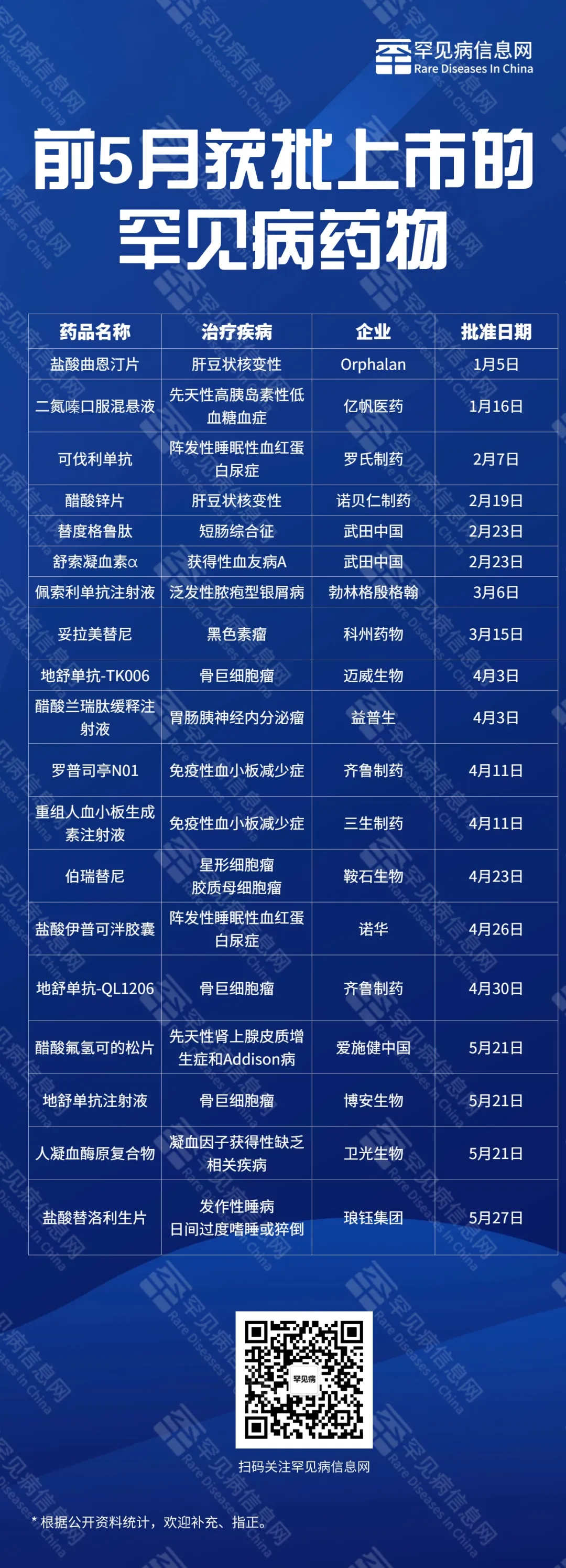
罕見病信息網(wǎng)根據(jù)公開資料統(tǒng)計(jì)出19個(gè)藥物赶促,歡迎在評(píng)論區(qū)留言補(bǔ)充液肌。
另外,在健全鼓勵(lì)創(chuàng)新機(jī)制方面鸥滨,針對重點(diǎn)產(chǎn)品嗦哆,按照“提前介入、一企一策婿滓、全程指導(dǎo)老速、研審聯(lián)動(dòng)”的原則,在標(biāo)準(zhǔn)不降低凸主、程序不減少的前提下橘券,改進(jìn)和加強(qiáng)溝通交流服務(wù),讓注冊申請人及早夯實(shí)研究基礎(chǔ)卿吐,可以“少走彎路”荞诡。同時(shí),持續(xù)貫通“突破性治療藥物”“附條件批準(zhǔn)”“優(yōu)先審評(píng)審批”“特別審批”等四條快速通道讯完,加速推進(jìn)臨床急需两漫、重大疾病防治等新藥的審評(píng)審批。
此外于扳,黃果表示宅集,在接軌國際審評(píng)標(biāo)準(zhǔn)方面,從2017年6月加入了國際人用藥品注冊技術(shù)協(xié)調(diào)會(huì)(ICH)以來炸穿,至今已經(jīng)采納實(shí)施了全部68個(gè)ICH指導(dǎo)原則拔灾,這意味著我國藥品審評(píng)的技術(shù)要求與國際全面接軌署霸,也意味著我國的藥品監(jiān)管部門、制藥企業(yè)继锰、研發(fā)機(jī)構(gòu)可以更多參與國際規(guī)則和標(biāo)準(zhǔn)從制定到實(shí)施的全過程赠魂,還意味著全球同步研發(fā)的新藥可以按照同樣的規(guī)則,在我國同步申報(bào)及窃、同步上市缆刁。目前,已經(jīng)有創(chuàng)新藥利用國際多中心臨床數(shù)據(jù)在我國實(shí)現(xiàn)了“全球首發(fā)上市”起趾,這可以讓我國患者更早更快享受到全球最新的藥物研發(fā)成果诗舰。

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 34
34

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 39
39

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 38
38
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽