
 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 藥明康德
藥明康德  2024-06-21
2024-06-21
 472
472
今天化团,Aurion Biotech宣布舞蔽,美國(guó)FDA授予其現(xiàn)貨型細(xì)胞療法AURN001突破性療法認(rèn)定(BTD)和再生醫(yī)學(xué)先進(jìn)療法(RMAT)認(rèn)定苔免。根據(jù)新聞稿瘾晃,AURN001是同時(shí)獲得BTD與RMAT認(rèn)定的首個(gè)同種異體細(xì)胞療法醒横,用于治療角膜內(nèi)皮疾病繼發(fā)的角膜水腫啸业。
繼發(fā)于內(nèi)皮功能障礙的角膜水腫是一種危及視力的衰弱性疾病胸牲,影響著全世界數(shù)百萬(wàn)人蒸咏。角膜內(nèi)皮細(xì)胞(CEC)死亡或退化后不會(huì)再生。如果不及時(shí)治療蝉蛙,角膜內(nèi)皮細(xì)胞損失會(huì)導(dǎo)致角膜水腫和視力受損悬坎。盡管角膜移植是有效的治療方式,但受到有限的供體器官數(shù)量所限制傅笨。傳統(tǒng)上進(jìn)行移植時(shí)伸义,一個(gè)健康的供體角膜僅能用于治療一個(gè)患病的眼睛晶恨。但據(jù)估計(jì),每70只患病眼只有一個(gè)供體角膜可用蛛挚。此外抗斤,這些手術(shù)具潛在術(shù)后恢復(fù)困難和并發(fā)癥的風(fēng)險(xiǎn),例如移植物脫離丈咐、移植排斥瑞眼、脫位、不規(guī)則散光和感染棵逊。而進(jìn)行角膜移植的患者在術(shù)后需要平躺長(zhǎng)達(dá)三天伤疙,以便移植的角膜能夠粘附在角膜基質(zhì)上×居埃基于以上種種限制徒像,這類患者存在著顯著的未滿足需求。
AURN001是一種一次性前房注射細(xì)胞療法與藥物的組合蛙讥,由同種異體人角膜內(nèi)皮細(xì)胞neltependocel和Rho相關(guān)蛋白激酶(ROCK)抑制劑Y-27632所組成锯蛀。這次FDA授予該療法的雙重認(rèn)定主要基于角膜內(nèi)皮疾病患者未滿足的醫(yī)療需求,以及FDA對(duì)AURN001相關(guān)臨床數(shù)據(jù)的審評(píng)次慢,該項(xiàng)目包括多項(xiàng)臨床試驗(yàn)旁涤,受試者已完成至少12個(gè)月的隨訪。
Aurion日前宣布已在美國(guó)和加拿大完成1/2期CLARA試驗(yàn)的招募和患者給藥迫像。CLARA臨床試驗(yàn)是一項(xiàng)前瞻性辙炒、多中心、隨機(jī)薇兆、雙盲牌君、平行臂細(xì)胞劑量范圍研究,研究對(duì)象為因角膜內(nèi)皮功能障礙而導(dǎo)致角膜水腫的受試者肯矾。該研究將評(píng)估三種不同劑量的neltependocel與Y-27632聯(lián)合使用的效果截剩。97名受試者已在美國(guó)和加拿大的試驗(yàn)中心隨機(jī)分組。CLARA試驗(yàn)旨在評(píng)估AURN001治療因角膜內(nèi)皮功能障礙而導(dǎo)致的角膜水腫的安全性需复、耐受性和有效性怠竞。主要終點(diǎn)是6個(gè)月時(shí)視力恢復(fù)3行的受試者百分比。
該公司曾在2018年于《新英格蘭醫(yī)學(xué)雜志》上發(fā)布其所開(kāi)發(fā)的CEC療法添加ROCK抑制劑組合拓郑,用以治療大泡性角膜病變患者的積極結(jié)果哨遭。分析顯示,細(xì)胞注射后24周节霸,在11只接受治療的眼睛中觀察到11只的CEC密度超過(guò)每平方毫米500個(gè)細(xì)胞(范圍:947-2833)骑跳,達(dá)成試驗(yàn)主要終點(diǎn)(100%,95% CI:72-100)。值得一提的是炉抒,其中10只眼睛的CEC密度超過(guò)每平方毫米1000個(gè)細(xì)胞奢讨。此結(jié)果顯示該細(xì)胞療法可能有效定植于患者眼部。
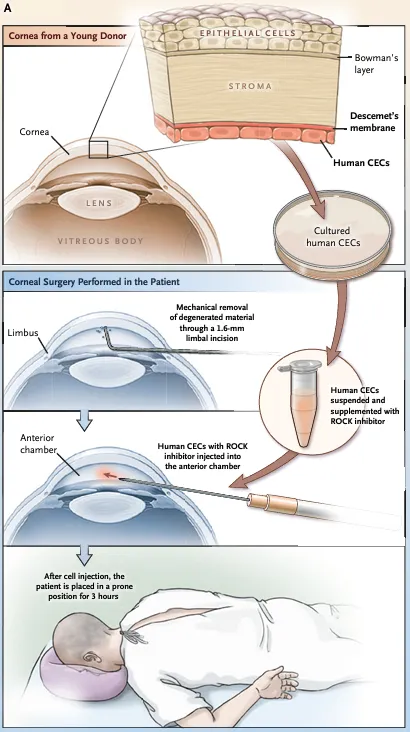
▲細(xì)胞療法注射的示意圖焰薄,將補(bǔ)充ROCK抑制劑所培養(yǎng)的人角膜內(nèi)皮細(xì)胞注射到前房(圖片來(lái)源:參考資料[3])
值得一提的是拿诸,去年3月,Aurion Biotech宣布其現(xiàn)貨型細(xì)胞療法Vyznova獲得日本醫(yī)藥品醫(yī)療器械綜合機(jī)構(gòu)(PMDA)上市批準(zhǔn)塞茅,用以治療大泡性角膜病變亩码。根據(jù)新聞稿,這是全球首個(gè)獲批用以治療角膜內(nèi)皮疾病的同種異體細(xì)胞療法野瘦。Vyznova是來(lái)自捐贈(zèng)者角膜的健康細(xì)胞通過(guò)Aurion專有的創(chuàng)新描沟、多步驟培養(yǎng),以產(chǎn)生完全分化的角膜內(nèi)皮細(xì)胞鞭光。此過(guò)程不需經(jīng)過(guò)基因編輯吏廉,來(lái)自單一捐贈(zèng)者完全分化的角膜內(nèi)皮細(xì)胞最終可用以治療超過(guò)100只患者眼睛。這些內(nèi)皮細(xì)胞通過(guò)前房?jī)?nèi)注射入患者眼中惰许,并在此處重新填充到健康單層中席覆,以進(jìn)行角膜中液體的清除,緩解角膜水腫忧绊。
現(xiàn)貨型細(xì)胞基因療法的開(kāi)發(fā)已逐漸成為產(chǎn)業(yè)趨勢(shì)略匕,近日產(chǎn)業(yè)界也迎來(lái)不少積極進(jìn)展。日前基列,IN8bio公司公布其在研現(xiàn)貨型γδ T細(xì)胞療法INB-100的最新1期臨床試驗(yàn)結(jié)果。白血病患者在接受造血干細(xì)胞移植后卿黍,接受一劑INB-100的治療军笑。在可評(píng)估的白血病患者中,100%在數(shù)據(jù)截止前仍然存活并且維持完全緩解達(dá)到1年见拴。而這個(gè)月擅暴,Wugen公司也公布其所開(kāi)發(fā)的在研CD7靶向、現(xiàn)貨型CAR-T療法WU-CART-007在用以治療復(fù)發(fā)/難治性T細(xì)胞急性淋巴細(xì)胞白血病/淋巴瘤(T-ALL/LBL)患者中的2期研究取得了積極結(jié)果馒毙。分析顯示项栈,有73%患者達(dá)成復(fù)合完全緩解率的主要終點(diǎn),總緩解率達(dá)91%疫壕。
此外映检,Precigen公司在這個(gè)月宣布其現(xiàn)貨型基因療法PRGN-2012治療復(fù)發(fā)性呼吸乳頭狀瘤病(RRP)患者的1/2期臨床試驗(yàn)達(dá)到主要終點(diǎn)秸谢。該公司計(jì)劃在2024年下半年通過(guò)加速批準(zhǔn)途徑提交PRGN-2012的滾動(dòng)生物制品許可申請(qǐng)(BLA)凛澎。新聞稿指出,如果獲得批準(zhǔn)估蹄,PRGN-2012有可能成為首個(gè)獲得FDA批準(zhǔn)用于治療RRP的療法塑煎。今年5月沫换,Atara Biotherapeutics向FDA提交現(xiàn)貨型同種異體T細(xì)胞療法tabelecleucel(tab-cel)的BLA,作為單藥療法最铁,用于治療愛(ài)潑斯坦-巴爾病毒(EBV)陽(yáng)性的移植后淋巴增殖性疾惭渡汀(PTLD)。新聞稿指出冷尉,如果獲批漱挎,tab-cel將成為FDA批準(zhǔn)的首款同種異體T細(xì)胞療法,以及治療EBV陽(yáng)性PTLD的首款療法网严。
參考資料:
[1] Aurion Biotech Receives Breakthrough Therapy Designation and Regenerative Medicine Advanced Therapy Designation for Its Drug Candidate AURN001. Retrieved June 19, 2024 from https://www.businesswire.com/news/home/20240619102413/en
[2] Aurion Biotech Announces Completion of Enrollment In Phase 1 / 2 Clinical Trial. Retrieved June 19, 2024 from https://aurionbiotech.com/aurion-biotech-announces-completion-of-enrollment-in-phase-1-2-clinical-trial/
[3] Kinoshita S, Koizumi N, Ueno M, Okumura N, Imai K, Tanaka H, Yamamoto Y, Nakamura T, Inatomi T, Bush J, Toda M, Hagiya M, Yokota I, Teramukai S, Sotozono C, Hamuro J. Injection of Cultured Cells with a ROCK Inhibitor for Bullous Keratopathy. N Engl J Med. 2018 Mar 15;378(11):995-1003. doi: 10.1056/NEJMoa1712770. PMID: 29539291.
[4] Corneal EndothelialCell Therapy. Retrieved June 19, 2024 from https://aurionbiotech.com/products/
[5] Aurion Biotech Receives Approval from Japan’s PMDA for New Drug Application. Retrieved June 19, 2024 from https://aurionbiotech.com/aurion-biotech-receives-approval-from-japans-pmda-for-new-drug-application/

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 深藍(lán)觀
深藍(lán)觀  2024-11-28
2024-11-28
 31
31

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 瞪羚社
瞪羚社  2024-11-28
2024-11-28
 36
36

 產(chǎn)業(yè)資訊
產(chǎn)業(yè)資訊
 丹諾醫(yī)藥
丹諾醫(yī)藥  2024-11-28
2024-11-28
 35
35
 熱門資訊
熱門資訊 熱點(diǎn)標(biāo)簽
熱點(diǎn)標(biāo)簽